
| 7.8g |
| 78g/mol |


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
| A、48 g O3气体含有6.02×1023个O3分子 |
| B、常温常压下,4.6 gNO2气体含有1.81×1023个NO2分子 |
| C、0.5 mol?L-1L CuCl2溶液中含有3.01×1023个Cu2+ |
| D、标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、焓变是指1 mol物质参加反应时的能量变化 |
| B、在一个确定的化学反应关系中,反应物的总焓与生成物的总焓一定不同 |
| C、反应放热时,△H>0;反应吸热时,△H<0 |
| D、在一个确定的化学反应关系中,反应物的总焓总是高于生成物的总焓 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 组别 | ① | ② | ③ | ④ |
| 混合粉末质量/g | 40 | 40 | 40 | 40 |
| V[FeCl3(aq)]/mL | 150 | 300 | 330 | 350 |
| 反应后剩余固体质量/g | 23.2 | 6.4 | 2.56 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:
 工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生产中保持恒温恒容条件):
工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生产中保持恒温恒容条件):| 2 |
| 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
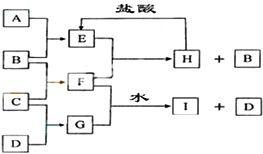 A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质.B、E均为组成空气的成分.F的焰色反应呈黄色.在G中非金属与金属元素的原子个数比为1:2.
A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质.B、E均为组成空气的成分.F的焰色反应呈黄色.在G中非金属与金属元素的原子个数比为1:2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com