
【题目】以NaCl等为原料制备KClO4的过程如下:
①在无隔膜、微酸性条件下,发生反应:NaCl+H2O![]() NaClO3+H2↑(未配平)
NaClO3+H2↑(未配平)
②在NaClO3溶液中加入KCl发生复分解反应,降温结晶,得KClO3。
③一定条件下反应:4KClO3![]() 3KClO4+KCl,将产物分离得到KClO4。
3KClO4+KCl,将产物分离得到KClO4。
(1)电解时,产生质量为2.13g NaClO3,同时得到H2的体积为 L(标准状况)。
(2)向NaClO3溶液中加入KCl能得到KClO3的原因是 。
(3)该过程制得的KClO4样品中含少量KCl杂质,为测定产品纯度进行如下实验:
准确称取5.689g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl-(反应为:3 KClO4+C6H12O6 ═ 6 H2O + 6 CO2↑+ 3 KCl),加入少量K2CrO4溶液作指示剂,用0.20mol/L AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积21.00mL。滴定达到终点时,产生砖红色Ag2CrO4沉淀。
① 已知: Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12,若c(CrO42-)=1.1×10-4mol/L,则此时c(Cl-)= mol/L。
② 计算KClO4样品的纯度(请写出计算过程。)
【答案】(1)1.344
(2)低温时,KClO3溶解度小,从溶液中结晶析出(2分,其它合理也可以得分)
(3)①1.8×10-6
②n(AgNO3)=0.2000 mol·L-1 ×0.021L=0.0042 mol (1分)
n(KCl)总=n(AgNO3)=0.0042 mol
n(KClO4)+ n(KCl)=0.0042 mol (1分)
n(KClO4) ×138.5 g·mol-1+ n(KCl) ×74.5 g·mol-1=0.56890g(1分)
n(KClO4)=0.0040 mol(1分)
m(KClO4)=0.004 mol×138.5 g·mol-1=0.554g(1分)
0.554g÷0.56890g×100%=97.38%(1分)
【解析】
试题分析:①在无隔膜、微酸性条件下,发生反应:NaCl+H2O![]() NaClO3+H2↑(未配平)
NaClO3+H2↑(未配平)
②在NaClO3溶液中加入KCl发生复分解反应,降温结晶,得KClO3。
③一定条件下反应:4KClO3![]() 3KClO4+KCl,将产物分离得到KClO4。
3KClO4+KCl,将产物分离得到KClO4。
(1)电解时,产生质量为2.13g NaClO3,其物质的量为![]() =0.02mol,根据电子守恒生成氢气的物质的量为0.02mol×6÷2=0.06mol,则H2的体积为0.06mol×22.4L/mol=1.344L;
=0.02mol,根据电子守恒生成氢气的物质的量为0.02mol×6÷2=0.06mol,则H2的体积为0.06mol×22.4L/mol=1.344L;
(2)低温时,KClO3溶解度小,向NaClO3溶液中加入KCl可析出KClO3晶体。
(3)① Ksp(Ag2CrO4)=c2(Ag+)×c(CrO42-)=1.1×10-12,当c(CrO42-)=1.1×10-4mol/L时c(Ag+)=1.0×10-4mol/L,c(Cl-)=Ksp(AgCl)÷c(Ag+)=1.8×10-6mol/L;
②n(AgNO3)=0.2000 mol·L-1 ×0.021L=0.0042 mol,n(KCl)总=n(AgNO3)=0.0042 mol
n(KClO4)+ n(KCl)含=0.0042 mol ,n(KClO4) ×138.5 g·mol-1+ n(KCl)含×74.5 g·mol-1=0.56890g,
n(KClO4)=0.0040 mol,m(KClO4)=0.004 mol×138.5 g·mol-1=0.554g,
0.554g÷0.56890g×100%=97.38%;


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】某同学为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折算为标准状况),实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL | 50 | 120 | 232 | 290 | 310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大 ,
原因是 。
(2)哪一时间段的反应速率最小 ,原因是
(3)求2~3 min时间段以盐酸的浓度变化来表示的该反应速率 。
(4)如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液: A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
你认为可行的是(填编号) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知热化学方程式:Zn(s)+1/2O2(g) =ZnO(s) △H1;Hg(l)+1/2O2(g) =HgO(s) △H2;
则Zn(s)+HgO(s)=Hg(l)+ZnO(s) △H值为 。(用△H1和△H2的代数式表示)
(2)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g)。若反应中4mol HCl被氧化,放出115.6kJ的热量,且部分化学键断裂示意图如下:
2Cl2(g)+2H2O(g)。若反应中4mol HCl被氧化,放出115.6kJ的热量,且部分化学键断裂示意图如下:
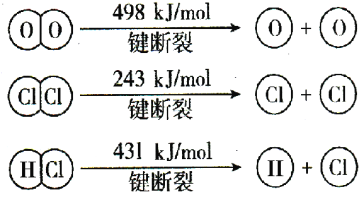
①反应A的热化学方程式是 。
②断开1 mol H—O键,需要吸收的能量为 kJ,H2O中H—O 键与HCl中H—Cl键相比, 的键能较大。(填“H—O”或“H—Cl”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,分别对反应C(S)+CO2(g)![]() 2CO(g)(△H>0)进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著变大的是( )
2CO(g)(△H>0)进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著变大的是( )
A.①②③④ B.①③④ C.①② D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知3.6g碳在6.4g氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知1mol单质碳完全燃烧放出热量为Y kJ,则1molC与O2反应生成CO的热量变化为
A.放出Y kJ B.放出(5X-5Y) kJ
C.放出(10X-Y) kJ D.吸收(10X-Y) kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁二酮肟![]() 是检验Ni2+的灵敏试剂。
是检验Ni2+的灵敏试剂。

(1)Ni2+基态核外电子排布式为 。丁二酮肟分子中C原子轨道杂化类型为 ,1mol丁二酮肟分子所含![]() 键的数目为 。
键的数目为 。
(2)Ni能与CO形成四羰基镍[Ni(CO)4],四羰基镍熔点-19.3℃,沸点42.1℃,易溶于有机溶剂。
①Ni(CO)4固态时属于 晶体(填晶体类型)。
②与CO互为等电子体的阴离子为 (填化学式)。
(3)Ni2+与Mg2+、O2—形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常利用铝粉和氧化铁反应来焊接铁轨。下列说法正确的是
A.氧化铝、氧化铁均为两性氧化物
B.氧化铝中的微粒半径:r(Al3+)>r(O2-)
C.在该反应中,铝的还原性强于铁的还原性
D.1mol氧化铁参加反应转移电子数约为4×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】仔细分析如图装置,完成下面的填空:

(1)该反应的电流方向是_____________。
(2)盐桥中的阴离子向________溶液中移动。
(3)一段时间后,锌片上的现象是_____________,铜片上的现象是______________。
(4)锌极发生_________反应,总反应方程式为_________________。
(5)30min后,1.3g的Zn参加了反应,则转移了_______个电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来各国都在寻找对环境无害而作用快速的消毒剂,其中二氧化氯(ClO2)是目前国际上倍受瞩目的第四代高效、无毒的消毒剂。工业上用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某兴趣小组的学生设计了如下模拟装置来制取、收集ClO2并测定其质量。
查阅资料:ClO2是一种黄红色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,温度过高可能引起爆炸,易溶于水,易与碱液反应。


实验Ⅰ:制取并收集ClO2,如图1装置所示。
(1)装置A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式__________。
(2)装置A必须添加温度控制装置,其温度要保持在60~80℃之间,控制温度的目的是__________。装置B也必须添加温度控制装置,应该是__________(填“冰水浴”或“沸水浴”或“60℃的热水浴”)装置。
实验Ⅱ:测定ClO2质量,如图2装置所示。过程如下:
在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;按照图2组装好仪器;在玻璃液封管中加入水,浸没导管口;将生成的ClO2气体由导管通入锥形瓶的溶液中充分吸收后,把玻璃液封管中的水封液倒入锥形瓶中,再向锥形瓶中加入几滴淀粉溶液:用cmol/L硫代硫酸钠标准液滴定锥形瓶中的液体,共用去VmL硫代硫酸钠溶液(己知:I2+2S2O32-=2I-+S4O62-)。
(3)装置中玻璃液封管的作用是____________________。
(4)滴定终点的现象是____________________。
(5)测得通入ClO2的质量m(ClO2)=__________g(用整理过的含c、V的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com