
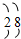 ,此元素在周期表中的位置是( )
,此元素在周期表中的位置是( )| A. | 第二周期零族 | B. | 第三周期ⅡA族 | C. | 第二周期ⅥA族 | D. | 第三周期IIIA |
科目:高中化学 来源: 题型:选择题
| A. | 适当加热新制的氯水时,溶液的pH逐渐减小 | |
| B. | 加催化剂,使N2和H2在一定条件下转化为NH3 | |
| C. | 可用浓氨水和氢氧化钠固体快速制取氨气 | |
| D. | 增大压强,有利于SO2与O2反应生成SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2 g | B. | 5.6 g | C. | 2.8 g | D. | 1.4 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
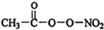 (PAN)等二次污染物.
(PAN)等二次污染物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第ⅠA族元素都是金属元素 | |
| B. | 第ⅣA族非金属元素的单质只能形成原子晶体 | |
| C. | 第ⅥA族元素形成的单质,常温下有气、液、固三种状态 | |
| D. | 元素性质呈现周期性变化的根本原因是元素原子最外层电子数呈现周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1>0 | B. | △H4=△H1-△H2-2△H3 | ||
| C. | △H4=△H2-△H1-2△H3 | D. | △H4-△H1-△H2<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
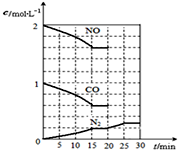 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com