
| ||
| 0.5L |
| W |
| 63 |
| ||||
| V×10-3L |
| 10W |
| 63V |
| 10W |
| 63V |


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源:不详 题型:单选题
| A.酸性KMnO4溶液 | B.饱和溴水 |
| C.NaOH溶液 | D.AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.步骤(2)中KMnO4表现还原性 |
| B.配制三草酸合铁酸钾溶液玻璃仪器只需烧杯和玻璃棒 |
| C.样品中结晶水的物质的量为0.03mol |
| D.该晶体的化学式为K3Fe(C2O4)3?3H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 实验 编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的 体积读数(mL) | 滴定后盐酸的 体积读数(mL) |
| 1 | 20.00 | 1.20 | 23.22 |
| 2 | 20.00 | 2.21 | 24.21 |
| 3 | 20.00 | 1.50 | 23.48 |
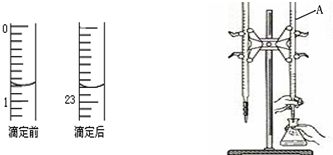
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
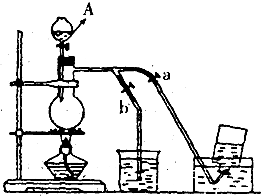
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com