
【题目】下图所示为镍锌可充电电池放电时电极发生物质转化的示意图,电池使用KOH和K2Zn(OH)4为电解质溶液,下列关于该电池说法正确的是
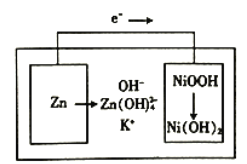
A. 放电时溶液中的K+移向负极 B. 充电时阴极附迁的pH会降低
C. 理论上负极质量每减少6.5g,溶液质量增加6.3g D. 放电时正极反应为H++NiOOH+e-=Ni(OH)2
【答案】C
【解析】A、根据原电池的工作原理,阳离子向正极移动,即K+放电时向正极移动,故A错误;B、根据电池的工作原理,电子从Zn流向另一极,即Zn为负极,负极反应式为Zn-2e-+4OH-=Zn(OH)42-,充电时,电池的负极接电源的负极,即充电时的电极反应式应是放电的逆过程,Zn(OH)42-+2e-=Zn+4OH-,阴极区pH增大,故B错误;C、负极反应式为Zn-2e-+4OH-=Zn(OH)42-,正极反应式:NiOOH+H2O+e-=Ni(OH)2+OH-,负极消耗6.5g锌,转移电子物质的量为6.5×2/65mol=0.2mol,溶液质量增加6.5g,正极上溶液减轻的H+,即通过0.2mol电子时,正极减轻质量为0.2×1g=0.3g,因此整个溶液质量增加(6.5-0.2)g=6.3g,故C正确;D、根据上述分析,锌作负极,则另一极为正极,正极上得到电子,化合价降低,故D错误。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】25℃时,向某Na2CO3溶液中加入稀盐酸,溶液中含碳微粒的物质的量分数(φ)随溶液pH变化的部分情况如图所示。下列说法中正确的是
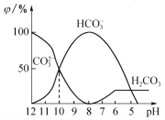
A. Na2CO3溶液中c(Na+)=c(CO32-)+ c(HCO3-)+ c(H2CO3)
B. pH=8时,溶液中c(Cl-)=c(Na+)
C. pH =7时,溶液中的c(Na+)>c(Cl-)>c(HCO3-)>c(H+)=c(OH-)
D. 25℃时,CO32-+H2O![]() HCO3-+OH-的Kh=10-10mol·L-1
HCO3-+OH-的Kh=10-10mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、有甲基、苯基、羟基、羧基四种基团,在它们两两组合形成的化合物中,写出具有以下性质的物质的结构简式:
(1)能使石蕊试液变色的有______种.
(2)催化氧化后产物能与新制氢氧化铜发生氧化还原反应的是______
(3)不同情况下与氢氧化钠反应能生成两种盐的是______.
II、有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取A 9.0 g,升温使其汽化,测其密度是相同条件下H2的45倍. | (1)A的相对分子质量为:________. |
(2)将此9.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g | (2)A的分子式为:________. |
(3)另取A 9.0 g,跟足量的NaHCO3粉末反应,生成2.24 L CO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况). | (3)用结构简式表示A中含有的官能团:________、________. |
(4)A的核磁共振氢谱如下图:
| (4)A中含有________种氢原子. |
(5)综上所述,A的结构简式________. | |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列有关叙述错误的是
A. 28g 由N2 与CO组成的混合气体中所含的原子数为2NA
B. 78g Na2O2 中所含的阴离子数为NA
C. 0.1molSO2 与0.1molO2充分反应后生成的SO2分子数为0.1 NA
D. 0.1molCu溶于足量稀硝酸中,转移的电子数为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在10 mL 0.1 molL-1Na2CO3溶液中逐滴加入0.1 molL-1的盐酸,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数的变化如图所示(CO2 因逸出未画出,忽略因气体遭出而引起的溶液体积变化),下列说法正确的是
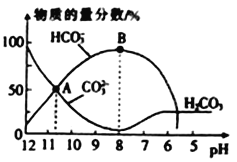
A. A点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+ c(OH-)
B. 在B点所示的溶液中,浓度最大的离子是HCO3-
C. 当熔液的pH 为7时,溶液中的阴离子只有两种
D. 已知25℃时,HCO3-的电离平衡常数Ka=5×10-11,当溶液的pH=10时,c(HCO3-)=2c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇的沸点是78℃,能与水以任意比混溶。乙醚的沸点为34.6℃,难溶于水,在饱和Na2CO3 溶液中几乎不溶,乙醚极易燃烧。实验室制醚的反应原理是:
2CH3CH2OH→H2O + CH3CH2—O—CH2CH3 (乙醚)
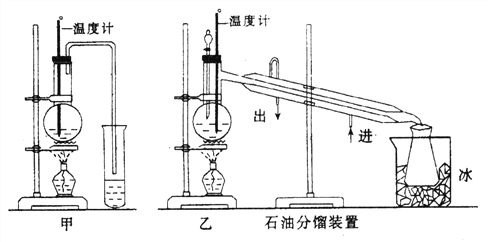
(1)甲图和乙图是两套实验室制乙醚的装置,选装置_________(填“甲”或“乙”)最合理,理由是______________________________。
(2)反应液中应加入沸石,其作用是____________________。
(3)反应中温度计的正确位置是水银球置于____________________。
(4)用装置乙制得的乙醚中可能含有大量的杂质,该杂质是__________,除去这种杂质的简易方法是__________________(提示:乙醚不溶于水,乙醇与水互溶)。
(5)如果温度太高,将会发生副反应,其产物名称为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常将铬镀在其他金属表面,同铁、镍组成各种性质的不锈钢,在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电板上无气体产生,铬电极上产生大量有色气体,则下列叙述正确的是
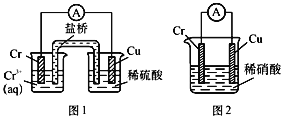
A. 图1为原电池装置,盐桥中的阴离子移向Cu电极的烧杯中
B. 由实验现象可知:金属活动性Cu>Cr
C. 图2装置中Cu电极上发生的电极反应式为:Cu-2e-=Cu2+
D. 两个装置中,电子均由Cr电极流向Cu电极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com