
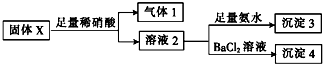
| A. | 气体1一定含NO可能含CO2 | |
| B. | 沉淀3一定含Mg(OH)2一定不含Al(OH)3 | |
| C. | 沉淀4可能为BaCO3、BaSO3或二者混合物 | |
| D. | 固体粉末X中一定有MgCl2和Na2SO3,可能有KAlO2 |
分析 固体X中可能含有MgCl2、Na2CO3、Na2SO3、KAlO2中的一种或几种,向X中加入足量稀硝酸得到气体1和溶液2,向溶液2中加入BaCl2得到沉淀4,沉淀4为BaSO4,则X含有Na2SO3,加入稀硝酸时发生的离子反应有3SO32-+2H++2NO3-=3SO42-+2NO↑+H2O,则气体1中一定含有NO;Na2CO3能和稀硝酸反应生成二氧化碳气体,所以气体1可能是NO和CO2或NO,溶液2和氨水反应生成沉淀3,沉淀3可能是Al(OH)3或Mg(OH)2或二者混合物,所以X中一定含有Na2SO3,可能含有Na2CO3,一定含有MgCl2、KAlO2中的一种或两种,据此分析解答.
解答 解:固体X中可能含有MgCl2、Na2CO3、Na2SO3、KAlO2中的一种或几种,向X中加入足量稀硝酸得到气体1和溶液2,向溶液2中加入BaCl2得到沉淀4,沉淀4为BaSO4,则X含有Na2SO3,加入稀硝酸时发生的离子反应有3SO32-+2H++2NO3-=3SO42-+2NO↑+H2O,则气体1中一定含有NO;Na2CO3能和稀硝酸反应生成二氧化碳气体,所以气体1可能是NO和CO2或NO,溶液2和氨水反应生成沉淀3,沉淀3可能是Al(OH)3或Mg(OH)2或二者混合物,所以X中一定含有Na2SO3,可能含有Na2CO3,一定含有MgCl2、KAlO2中的一种或两种,
A.通过以上分析知,气体1一定含NO可能CO2,故A正确;
B.通过以上分析知,沉淀3可能是Al(OH)3或Mg(OH)2或二者混合物,故B错误;
C.稀硝酸足量,所以亚硫酸根离子完全被氧化生成硫酸根离子,且碳酸根离子完全反应生成二氧化碳,则沉淀一定是BaSO4,故C错误;
D.X中一定含有Na2SO3,可能含有Na2CO3,一定含有MgCl2、KAlO2中的一种或两种,故D错误;
故选A.
点评 本题考查物质鉴别及检验实验方案设计,为高频考点,明确物质性质及物质之间的反应是解本题关键,注意稀硝酸的强氧化性,稀硝酸能氧化亚硫酸根离子生成硫酸根离子,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 等质量的乙烯和丙烯中含有的共用电子对数 | |
| B. | 等物质的量的水与重水含有的中子数 | |
| C. | 同温、同压、同体积的CO和NO含有的质子数 | |
| D. | 等物质的量的铁和铝分别与足量盐酸完全反应时转移的电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe 2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向1mL0.2mol/LNaOH溶液中滴入2滴0.1mol/LMgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下,溶解度:Mg(OH)2>Fe(OH)3 |
| B | 向两份等体积等浓度的H2O2溶液中,分别滴入等浓度等体积CuSO4、KMnO4溶液,后者产生气体较多 | 证明KMnO4溶液的催化效率更高 |
| C | 测定相同物质的量浓度的硅酸钠 和碳酸钠溶液的PH,前者较大 | 证明非金属性:C>Si |
| D | 向FeCl3溶液中加入铁钉,溶液颜色变浅 | 证明FeCl3溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+(aq)+OH-(aq)═H2O(l)△H=+57.3kJ•mol-1 | |
| B. | 加入少量蒸馏水,平衡①和②均向右移动 | |
| C. | 溶液中c(CH3COOH)>c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 加入少量CaCl2溶液,所得溶液中:c(CH3COOH)+2c(OH-)=c(CH3COO-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com