
【题目】下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法正确的是( )
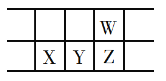
A.原子半径:W>Z
B.常温下,X的单质与Y的单质均能溶于浓硫酸
C.X的最高价氧化物的水化物是强碱
D.最简单气态氢化物热稳定性:Z<W
【答案】D
【解析】
W、X、Y、Z为短周期主族元素,根据位置关系可以看出,W的族序数比X多2,由主族元素族序数数值上等于该元素的最高化合价(F、O除外)可知,设X的族序数为a,则W的族序数为a+2,W与X的最高化合价之和为8,则有a+2+a=8,解得a=3,故X位于第ⅢA族,为Al元素,因此Y为Si元素,Z为P元素,W为N元素,据此分析解答。
A.W、Z属于同一主族,同一主族原子半径自上而下依次增大,则原子半径:W>Z,A选项错误;
B.X的单质为铝单质,遇到浓硫酸会发生钝化,不能溶于浓硫酸,Y的单质为硅单质,硅单质之溶于HF一种酸,B选项错误;
C.X的最高价氧化物对应的水化物为Al(OH)3,为弱碱,C选项错误;
D.非金属性:P<N,非金属性越强,简单气态氢化物的热稳定性越强,故热稳定性:NH3>PH3,D选项正确;
答案选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】我国成功研制出了具有自主知识产权的治疗缺血性脑梗死新药——丁苯酞。有机物G是合成丁苯酞的中间产物,G的一种合成路线如图:

已知:R-Br![]() R-MgBr
R-MgBr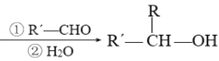
回答下列问题:
(1)A的结构简式是___,E的化学名称是___。
(2)由B生成C的化学方程式为___。
(3)G的结构简式为___。合成丁苯酞的最后一步转化为: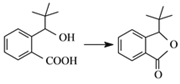 ,则该转化的反应类型是___。
,则该转化的反应类型是___。
(4)参照题中信息和所学知识,写出用![]() 和CH3MgBr为原料(其他无机试剂任选)制备
和CH3MgBr为原料(其他无机试剂任选)制备![]() 的合成路线:___。
的合成路线:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国第二化工设计院提出,用间接电化学法对大气污染物 NO 进行无害化处理,其原理示意如图(质子膜允许H+和 H2O 通过),下列相关判断正确的是
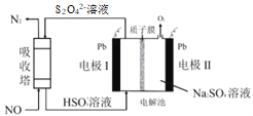
A.电极Ⅰ为阴极,电极反应式为 2H2O+2e- =2OH- +H2↑
B.电解池中质子从电极Ⅰ向电极Ⅱ作定向移动
C.吸收塔中的反应为 2NO+ 2S2O42-+H2O=N2+4HSO3-
D.每处理1molNO电解池质量减少16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增。已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的1/2,F是同周期元素中原子半径最小的元素;D2﹣与E2+的电子层结构相同。B与D可以形成三原子化合物甲。A是非金属元素,且A、C、F可形成离子化合物乙。请回答:
(1)C单质的电子式_____,F元素原子的电子排布式_____,E元素的原子结构示意图是_____;
(2)化合物乙中含有的化学键是_____;
(3)化合物甲的结构式_____,固体时属于_____晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚铁(白色固体,难溶于水)是一种重要的工业原料,可用于制备补血剂乳酸亚铁,也可用作可充电电池的电极。某研究小组通过下列实验,寻找利用复分解反应制备FeCO3的最佳方案:
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
| 0.8 mol/L FeSO4溶液 (pH=4.5) | 1 mol/L Na2CO3溶液 (pH=11.9) | 实验Ⅰ:立即产生灰绿色沉淀,5min后出现明显的红褐色 |
0.8 mol/L FeSO4溶液 (pH=4.5) | 1 mol/L NaHCO3溶液 (pH=8.6) | 实验Ⅱ:产生白色沉淀及少量无色气泡,2min后出现明显的灰绿色 | |
0.8 mol/L (NH4)2Fe(SO4)2 溶液(pH=4.0) | 1 mol/L NaHCO3溶液 (pH=8.6) | 实验Ⅲ:产生白色沉淀及无色气泡,较长时间保持白色 | |
(1)实验I中红褐色沉淀产生的原因可用如下反应表示,请补全反应:_____________
![]() Fe2++
Fe2++ ![]() +
+ ![]() +
+ ![]() H2O
H2O ![]()
![]() Fe(OH)3 +
Fe(OH)3 + ![]() HCO3
HCO3
(2)实验II中产生FeCO3的离子方程式为__________________。
(3)为了探究实验III中NH4+所起的作用,甲同学设计了实验IV进行探究:
操作 | 现象 | |
实验IV | 向0.8 mol/L FeSO4溶液中加入________,再加入一定量Na2SO4固体配制成混合溶液(已知Na+对实验无影响,忽略混合后溶液体积变化)。再取该溶液一滴管,与2mL 1mol/L NaHCO3溶液混合 | 与实验III现象相同 |
实验IV中加入Na2SO4固体的目的是_________。
对比实验II、III、IV,甲同学得出结论:NH4+水解产生H+,降低溶液pH,减少了副产物Fe(OH)2的产生。
乙同学认为该实验方案不够严谨,应补充的对比实验操作是:_________,再取该溶液一滴管,与2mL 1mol/L NaHCO3溶液混合。
(4)小组同学进一步讨论认为,定性实验现象并不能直接证明实验III中FeCO3的纯度最高,需要利用如图所示的装置进行定量测定。分别将实验I、II、III中的沉淀进行过滤、洗涤、干燥后称量,然后转移至A处的广口瓶中。

① 补全A中装置并标明所用试剂。____________
② 为测定FeCO3的纯度,除样品总质量外,还需测定的物理量是____________。
(5)实验反思:经测定,实验III中的FeCO3纯度高于实验I和实验II。通过以上实验分析,制备FeCO3实验成功的关键因素是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiO2和TiCl4均为重要的化工原料,已知:
Ⅰ.TiCl4(g)+O2(g)![]() TiO2(s)+2Cl2(g) ΔH=-175.4kJ/mol
TiO2(s)+2Cl2(g) ΔH=-175.4kJ/mol
Ⅱ.2C(s)+O2(g)![]() 2CO(g) ΔH=-220.9kJ/mol
2CO(g) ΔH=-220.9kJ/mol
请回答下列问题:
(1)TiCl4(g)+2CO(g)![]() TiO2(s)+2C(s)+2Cl2(g)的ΔH=___kJ/mol。
TiO2(s)+2C(s)+2Cl2(g)的ΔH=___kJ/mol。
(2)t℃时,向10L恒容密闭容器中充入1molTiCl4和2molO2,发生反应I,4min达到平衡时测得TiO2的物质的量为0.2mol。
①反应0~4min末的平均速率v(Cl2)=_,该温度下K=_(用分数表示),O2的平衡转化率=__。
②下列措施,既能加快正反应速率,又能增大O2的平衡转化率的是_。
A.缩小容器的体积
B.加入催化剂
C.分离出部分TiO2
D.增加O2的浓度
E.减低温度
F.以上方法均不可以
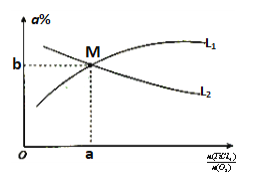
③t℃时,向10L恒容密闭容器中充入3molTiCl4和一定量的O2,发生反应I,两种气体的平衡转化率(a%)与起始的物质的量之比(TiCl4/O2)的关系如图1所示:能表示O2的平衡转化率的曲线为___(填“L1”或“L2”),M点的坐标为___(用整数或分数表示)。
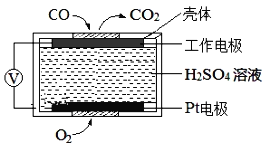
(3)CO是有毒气体,测定空气中CO含量常用的方法之一是电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为___;为减少对环境造成的影响,用CO和H2可以制备甲醇(CH3OH),以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中溶质的主要成分是___(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法错误的是( )
A.密闭容器中,2molSO2和1molO2催化反应后分子总数大于2NA
B.1LpH=2的H2SO3溶液中含H+的数目为0.01NA
C.5.6g铁与稀硝酸反应生成0.08molNO,转移电子数为0.3NA
D.6.4 g S2和S8的混合物中所含硫原子数为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2又名黑锰矿,主要用于生产优质软磁铁氧体。MnO2的合成方法按制备工艺中所用原料的不同,分为固相合成和液相合成。已知:MnO2不溶于水,其中锰的价态有+2价,也可能有+3价和+4价。请回答下列问题:
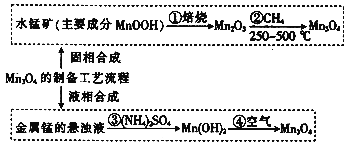
(1)若Mn3O4中锰的价态看作由+2和+4价组成,写出它由氧化物形成的表达式:_____
(2)MnOOH中锰的价态为________价,写出②的化学方程式:____;碱性锌锰干电池的电池反应为:Zn+2MnO2 + 2H2O=Zn(OH)2 + 2MnOOH,写出该电池正极的电极反应式______
(3)将(NH4)2SO4溶于水使锰的悬浊液显酸性,随即缓慢地产生气泡,试用相应的离子方程式解释原因____________。过滤出的Mn(OH)2需要洗涤,简要说明洗涤沉淀的操作过程:________。
(4)若③中收集到672mL(标准状况下)的H2,则理论上可以得到_________g Mn3O4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关分子式为C8H10O的芳香化合物的推断正确的是( )
A.若C8H10O能与溴水发生取代反应,则1mol该有机物最多消耗2molBr2
B.若C8H10O遇FeCl3溶液不发生显色反应,则苯环上只能有一个取代基
C.若C8H10O能与NaOH溶液反应,则产物的化学式为C8H9ONa
D.若C8H10O能发生消去反应,则该有机物只有一种结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com