
【题目】重要化工原料CuSO4的制备途径及性质如图所示。下列说法错误的是
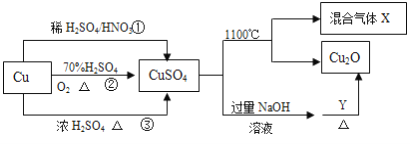
A. 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2
B. 相对于途径①、③,途径②更好地体现了绿色化学思想
C. Y物质具有还原性,可以是葡萄糖
D. 1molCuSO4在1100℃所得混合气体X中O2一定为0.75mol
【答案】D
【解析】A.Cu与混酸反应,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,离子反应为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,从方程式知,硝酸根离子由硝酸提供,氢离子由硝酸和硫酸提供,所以硝酸为2mol时,硫酸为3mol,用混酸中H2SO4与HNO3物质的量之比最好为3:2,故A正确;
B.相对于途径①、③,途径②的优点:制取等质量胆矾需要的硫酸少、途径2无污染性气体产生,故B正确;
C、葡萄糖与氢氧化铜反应的方程式为:C6H12O6+2Cu(OH)2=C6H12O7+Cu2O+2H2O,所以Y可为葡萄糖,故C正确;
D、根据2CuSO4═Cu2O+SO2↑+SO3↑+O2↑知,1molCuSO4在1100℃所得混合气体X中O2为0.5mol,故D错误;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】
对甲苯丙烯酸甲酯 (E)是一种用于合成抗血栓药的中间体,其合成路线如下:
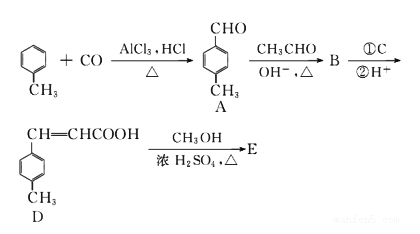
已知:HCHO+CH3CHO![]() CH2=CHCHO+H2O
CH2=CHCHO+H2O
(1)A中官能团的名称为_______,A分子中核磁共振氢谱各峰值比为________。
(2)物质B的结构简式为_______,生成E的反应类型为__________。
(3)试剂C可选用下列中的_________。
a.溴水 b.银氨溶液 c.酸性KMnO4溶液 d.新制Cu(OH)2悬浊液
(4)![]() 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为__________________。
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为__________________。
(5)遇FeCl 3溶液显紫色,且苯环上有两个取代基的A的同分异构体有______种,E在一定条件下可以生成高聚物F,F的结构简式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容下,有反应2A(g)+2B(g)![]() C(g)+3D(g),现从两条途径分别建立平衡。途径Ⅰ:A、B的起始浓度均为2mol·L-1;途径Ⅱ:C、D的起始浓度分别为2mol·L-1和6mol·L-1。以下叙述正确的是( )
C(g)+3D(g),现从两条途径分别建立平衡。途径Ⅰ:A、B的起始浓度均为2mol·L-1;途径Ⅱ:C、D的起始浓度分别为2mol·L-1和6mol·L-1。以下叙述正确的是( )
A. 达到平衡时,途径Ⅰ的反应速率等于途径Ⅱ的反应速率
B. 达到平衡时,途径Ⅰ所得混合气体的压强等于途径Ⅱ所得混合气体的压强
C. 两途径最终达到平衡时,体系内各组分的百分含量相同
D. 两途径最终达到平衡时,体系内各组分的百分含量不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固定容积为2 L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g),图I表示200℃时容器中各物质的量随时间的变化关系,图II表示平衡时平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是
zC(g),图I表示200℃时容器中各物质的量随时间的变化关系,图II表示平衡时平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是

A. 200℃时,反应从开始到平衡的平均速率v(A)=0.08molL-1min-1
B. 200℃时,若在第6 min再向体系中充入1 mol He,此时v(正)>v(逆)
C. 若0~5 min内容器与外界的热交换总量为m kJ,则该反应的热化学方程式可表示为:2A(g)+B(g)![]() C(g) ΔH= +5m kJ/mol
C(g) ΔH= +5m kJ/mol
D. 200℃时,平衡后再充入2 mol C,则再次达到平衡时,C的体积分数等于0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由钾和氧组成的某种离子晶体中含钾的质量分数为78/126,其阴离子只有过氧离子(O22-)和超氧离子(O2-)两种。在此晶体中,过氧离子和超氧离子的物质的量之比为
A. 2︰1 B. 1︰1 C. 1︰2 D. 1︰3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱厂电解饱和食盐水制取NaOH的化学反应方程式为:2NaCl + H2O![]() 2NaOH + H2↑+ Cl2↑,工艺流程示意图如下:
2NaOH + H2↑+ Cl2↑,工艺流程示意图如下:

下表是NaCl和MaOH在水中的溶解度
温度 物质 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
NaCl | 35.7g | 36g | 36.6g | 37.3g | 38.4g | 39.8g |
NaOH | 42g | 109g | 129g | 174g | 314g | 347g |
依据示意图和表,完成下列填空:
(1)工业食盐中含CaCl2、MgCl2等杂质。除去Ca2+、Mg2+过程发生反应的化学反应方程式为_____。
(2)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过______、冷却、______(填写操作名称)除去NaCl。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是________(填字母序号)。
①Ba(NO3)2 ②BaCl2
(4)为了有效地除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为_______(少选多选都不计分)。
A.先加NaOH,后加Na2CO3,再加钡试剂 B.先加Na2CO3,后加钡试剂,再加NaOH
C.先加钡试剂,后加NaOH,再加Na2CO3 D.先加NaOH,后加钡试剂,再加Na2CO3
(5)用制得的 NaOH固体配制 240 mL0.2mol/L NaOH 溶液。
①配制时,必須使用的玻璃仪器有______________________。
②某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图。
烧杯的实际质量为________________g。

③在配制过程中,其他操作都是正确的,下列情对所配制的NaOH珩液的浓度偏高有_____。
A.没有洗涤烧杯和玻璃棒 B.容量瓶不干燥,含有少量蒸馏水
C.定容时俯视刻度线 D.定容时仰视刻度线
E.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线。
④下图是该同学转移溶液的示意图,图中的错误是_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是
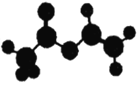
A. 该化合物的名称为乙酸乙酯
B. 该化合物的链状同分异构体中,能与NaHCO3反应放出CO2的只有3种
C. 该化合物既能发生水解反应.又能发生缩聚反应
D. 该化合物与Br2的四氯化碳溶液不反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com