
| A. | 反应中有水参加反应 | |
| B. | 反应后溶液呈无色 | |
| C. | 该反应的还原剂为K2S2O8 | |
| D. | MnSO4和K2S2O8的化学计量数分别为、2 |
分析 根据反应物为硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液,生成物为高锰酸钾、硫酸钾和硫酸,利用质量守恒定律和电子守恒来写出并配平上述反应的化学方程式为2MnSO4+5K2S2O8+8H2O=2KMnO4+4K2SO4+8H2SO4,Mn元素的化合价由+2价升高到+7价,则MnSO4为还原剂,S元素的化合价由+7降低为+6价,则K2S2O8为氧化剂,据此分析.
解答 解:A、由信息可知,反应物与生成物,则MnSO4+K2S2O8+H2O→KMnO4+K2SO4+8H2SO4,Mn元素的化合价由+2价升高到+7价,S元素的化合价由+7降低为+6价,
由电子守恒及质量守恒定律可知,配平的化学反应为2MnSO4+5K2S2O8+8H2O=2KMnO4+4K2SO4+8H2SO4,所以有水参加反应,故A正确;
B、因生成KMnO4为紫色,所以反应后溶液呈紫红色,故B错误;
C、2MnSO4+5K2S2O8+8H2O=2KMnO4+4K2SO4+8H2SO4,Mn元素的化合价由+2价升高到+7价,则MnSO4为还原剂,S元素的化合价由+7降低为+6价,则K2S2O8为氧化剂,故C错误;
D、由2MnSO4+5K2S2O8+8H2O=2KMnO4+4K2SO4+8H2SO4,MnSO4和K2S2O8的化学计量数分别为2、5,故D错误;
故选:A.
点评 本题考查氧化还原反应,明确反应物与生成物并利用化合价的变化来写反应方程式是解答本题的关键,并注意电子守恒的应用来解答此类习题.


科目:高中化学 来源: 题型:选择题
| A. | 向氯化铝溶液中加入过量稀氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | 向小苏打溶液中加入醋酸溶液:HCO3-+CH3COOH═CH3COO-+CO2↑+H2O | |
| C. | 苯酚钠溶液中通入二氧化碳CO2+H2O+2C6H5O-→2C6H5OH+CO32- | |
| D. | 向溴化亚铁溶液中通入过量氯气Fe2++2Br-+2Cl2═Fe3++Br2+4Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
 ,产物的结构简式为
,产物的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1>△H2 | B. | △H2=△H1+△H4 | C. | △H3=△H2-△H5 | D. | △H4<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1m ol | B. | 0.5mol | C. | 0.275mol | D. | 0.25mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
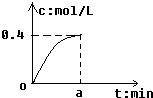 反应2SO2+O2?2SO3经amin后,SO3浓度的变化情况如图所示,在时间0-amin内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )
反应2SO2+O2?2SO3经amin后,SO3浓度的变化情况如图所示,在时间0-amin内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )| A. | 0.1 | B. | 2.5 | C. | 5 | D. | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 130ml | B. | 100ml | C. | 90ml | D. | 50ml |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com