
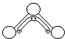
 1949年度诺贝尔化学奖授予为研究臭氧做出特殊贡献的化学家.O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图所示:呈V型,键角116.5°.三个O原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键(虚线内部分)-三个O原子均等地享有这4个电子.请回答:
1949年度诺贝尔化学奖授予为研究臭氧做出特殊贡献的化学家.O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图所示:呈V型,键角116.5°.三个O原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键(虚线内部分)-三个O原子均等地享有这4个电子.请回答:分析 (1)中心的氧原子与两旁的配位氧原子键合生成两个σ键,同时三个原子形成一个三中心四电子的大π键;
(2)根据等电子原理进行分析,等电子体的结构相似,O3中原子数为3、电子总数为24,据此分析;
(3)由臭氧的结构图可知中心O原子有4个电子成键,两端的O原子各有2个电子成键.
解答 解:(1)在臭氧O3中,中心的氧原子以sp2杂化,与两旁的配位氧原子键合生成两个σ键,使O3分子称折线形,在三个氧原子之间还存在着一个垂直于分子平面的大π键,
故答案为:σ;π;
(2)等电子原理:原子数相同、电子总数相同的分子,互称为等电子体.等电子体的结构相似,O3中原子数为3、电子总数为24,
A.H2O中原子数为3、电子总数为10,故A不选;
B.CO2中原子数为3、电子总数为22,故B不选;
C.SO2中原子数为3、电子总数为24,故C选;
D.BeCl2中原子数为3、电子总数为38,故D不选,
故答案为:C;
(3)每个O原子最外层有6个电子,由臭氧的结构图可知中心O原子有4个电子成键,则还有1对孤电子对,两端的O原子各有2个电子成键,则两端的O原子的各含有2对孤电子对,所以臭氧分子中总共5对孤电子对,
故答案为:5.
点评 本题考查臭氧的结构及极性分子、等电子体的判断,题目难度中等.注重基础知识应用的考查.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:解答题
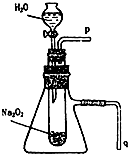 某课外活动小组在做实验时用脱脂棉花包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来.
某课外活动小组在做实验时用脱脂棉花包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2007年诺贝尔物理学奖为法国科学家阿尔贝•费尔和德国科学家彼得•格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就.某钙钛型复合氧化物(如图1),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应.
2007年诺贝尔物理学奖为法国科学家阿尔贝•费尔和德国科学家彼得•格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就.某钙钛型复合氧化物(如图1),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核都是由质子和中子构成 | |
| B. | 质子数相同的粒子其化学性质不一定相同 | |
| C. | 某种粒子最外层上有8个电子,则一定是稀有气体元素的原子 | |
| D. | 原子电子构型为ns2np6的为稀有气体元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒温下,将容器体积变为原来2倍,CO的平衡浓度变为原来的$\frac{1}{2}$ | |
| B. | 恒温恒容下,增大压强,H2浓度一定减小 | |
| C. | 升高温度,正反应速率减小,逆反应速率增大 | |
| D. | 该反应化学方程式为CO2+H2?CO+H2O△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液中滴加足量氨水 | |
| B. | 向酚酞试液中通入过量Cl2 | |
| C. | 向紫色石蕊试液中通入过量SO2 | |
| D. | 向酚酞试液中加入Na2O2粉末至过量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com