
| A. | 达到化学平衡时,N2完全转化为NH3 | |
| B. | 达到化学平衡时,正反应和逆反应的速率都为零 | |
| C. | N2、H2和NH3的物质的量浓度不再变化时,反应达到平衡 | |
| D. | 单位时间内每增加1molN2,同时增加3molH2时,反应达到化学平衡 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、可逆反应是反应物和生成物共存的体系,不可能完全转化,故A错误;
B、化学平衡是动态平衡,当反应达到平衡状态时,正逆反应速率相等,但不为0,故B错误;
C、N2、H2和NH3的物质的量浓度不再变化时,说明各物质的量不变,正逆反应速率相等,故C正确;
D、单位时间内每增加1molN2,同时增加3molH2时,都反映的逆向,未体现正与逆的关系,故D错误;
故选C.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含有Fe3+大量的溶液中:NH4+、Na+、Cl-、SCN- | |
| B. | 某无色透明溶液:NH4+、K+、SO32-、Cr2O72- | |
| C. | 在c(H+)=0.1mol/L的溶液中:K+、Mg2+、Cl-、NO3- | |
| D. | 在能与Al反应产生H2的溶液中:NH4+、NO3-、SO42-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+H2$\stackrel{催化剂}{→}$C2H6 | |
| B. | 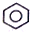 +HNO3$→_{55-60℃}^{浓H_{2}SO_{4}}$ +HNO3$→_{55-60℃}^{浓H_{2}SO_{4}}$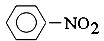 +H2O +H2O | |
| C. | CH3COOCH2CH3+H2O$→_{△}^{稀H_{2}SO_{4}}$CH3COOH+CH3CH2OH | |
| D. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的摩尔质量为18g | |
| B. | 1 mol/L K2SO4溶液所含K+数目为2NA | |
| C. | 在常温常压下,2g氢气的体积为22.4L | |
| D. | 1 mol Mg2+的质量为24g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com