
| A. | 金刚石>晶体硅>晶体硅>二氧化硅>碳化硅 | |
| B. | 氟化氢>碘化氢>溴化氢>氯化氢 | |
| C. | 氧化镁>氧气>氮气>水 | |
| D. | 铯>铷>钾>钠 |
分析 A.原子晶体中半径越小,键长越短,共价键越强,熔点越大;
B.组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越大,若形成分子间氢键,熔沸点反常升高;
C.离子晶体的熔沸点大于分子晶体,水中含有氢键,熔、沸点比氮气、氧气的大;
D.金属晶体中,金属阳离子半径越小、所带电荷数越多,熔沸点越高.
解答 解:A.原子晶体中共价键的键长越短,键能越大,熔、沸点越大,则熔、沸点为金刚石>二氧化硅>碳化硅>晶体硅,故A错误;
B.组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越大,若形成分子间氢键,熔沸点反常升高,则熔、沸点为HF>HI>HBr>HCl,故B正确;
C.离子晶体的熔沸点大于分子晶体,水中含有氢键,熔、沸点比氮气、氧气的大,则熔、沸点为MgO>H20>O2>N2,故C错误;
D.金属晶体中,金属阳离子半径越小、所带电荷数越多,熔沸点越高,同主族金属从上到下,金属键减弱,熔、沸点降低,故D错误;
故选B.
点评 本题考查不同类型晶体的熔沸点比较,明确不同类型晶体的熔沸点比较方法是解答本题的关键,注意水中含有氢键及合金与组成金属的熔点的关系即可解答,题目难度不大.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
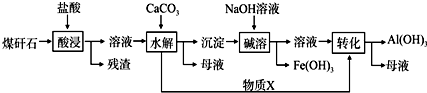
 .该工艺设计中,过量X参与反应的离子方程式是:AlO2-+CO2+2H2O=Al(OH)3+HCO3-.
.该工艺设计中,过量X参与反应的离子方程式是:AlO2-+CO2+2H2O=Al(OH)3+HCO3-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从100mL1.0mol•L-1的NaOH溶液中取出10mL该溶液,其溶液浓度仍为1.0mol•L-1 | |
| B. | 分离酒精和水可以采用分液的方法 | |
| C. | 在蒸发NaCl溶液时,等蒸发至少量液体时,停止加热,利用余热继续蒸干 | |
| D. | 在盛有碘水的试管中加入少量的CCl4后,充分振荡后下层颜色变为紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,
,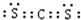 ,结构式是:S=C=S.
,结构式是:S=C=S.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2 | |
| B. | 1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2 | |
| C. | 0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2 | |
| D. | 0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有化学键被破坏的变化不一定是化学变化 | |
| B. | 金属元素与非金属元素原子间形成的化学键不一定是离子键 | |
| C. | 乙炔分子中,σ键与π键数目之比为1:1 | |
| D. | 金刚石中碳原子采取sp3杂化,12g金刚石中含2mol 碳碳单键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 +H2O$→_{②H+}^{①OH-,△}$
+H2O$→_{②H+}^{①OH-,△}$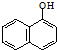 +CO2↑+CH3NH2,
+CO2↑+CH3NH2,| A. | 西维因是一种芳香烃 | |
| B. | 西维因苯环上一溴取代产物有4种情况 | |
| C. | 可用FeCl3溶液检验西维因是否发生水解 | |
| D. | 在Ni催化下1mol西维因最多能与6molH2加成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com