
| A. | 电泳 | B. | 丁达尔效应 | C. | 布朗运动 | D. | 渗析 |
分析 胶体的表面积较大,胶体粒子能吸附电荷带电,加电压时会定向移动,发生电泳,可证明胶体粒子带电荷.
解答 解:A.胶体不带电,胶体具有吸附性,吸附带电荷的离子,加电压时会定向移动,发生电泳,可证明胶体粒子带电荷,故A正确;
B.当一束光线透过胶体,从入射光的垂直方向可以观察到胶体里出现的一条光亮的“通路,不能证明胶体粒子带电荷,故B错误;
C.布朗运动是液体内部分子做无规则运动时,对悬浮小颗粒碰撞作用的不平衡所引起的,布朗运动是液体分子无规则运动的反映,不能证明胶体粒子带电荷,故C错误;
D.渗析是一种以浓度差为推动力的膜分离操作,实现不同性质溶质的分离,可提纯胶体,不能证明胶体粒子带电荷,故D错误;
故选A.
点评 本题考查胶体的性质,题目难度不大,掌握胶体粒子带电荷的原因是解答关键.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:实验题
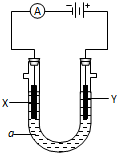 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连. 请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连. 请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
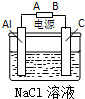 甲、乙、丙三位同学按下列方法制取氢氧化铝,请你参与并回答有关问题.
甲、乙、丙三位同学按下列方法制取氢氧化铝,请你参与并回答有关问题.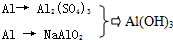
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 我国有较长的海岸线,浩瀚的海洋是一个巨大的物质资源和能量的宝库.目前,世界各国都在研究如何充分利用海洋资源.全球海水中的溴的储量丰富,约占地球溴总储量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg•L-1.其工业提取法有:
我国有较长的海岸线,浩瀚的海洋是一个巨大的物质资源和能量的宝库.目前,世界各国都在研究如何充分利用海洋资源.全球海水中的溴的储量丰富,约占地球溴总储量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg•L-1.其工业提取法有:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
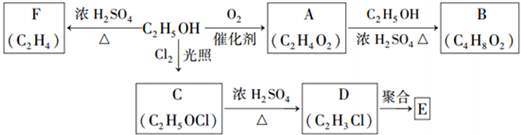
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
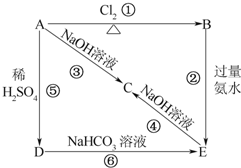 图示中,E是不溶于水的白色胶状物质.
图示中,E是不溶于水的白色胶状物质.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
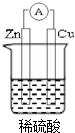 若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池,试回答:
若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3-CH2OH | B. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | ||
| C. | CH4$\stackrel{高温}{→}$C+2H2 | D. | CH≡CH+HCl$→_{△}^{催化剂}$CH2═CHCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
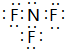 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com