
【题目】有A、B、C、D、E五种短周期元素,它们的原子序数依次增大。已知A和B原子具有相同的电子层数,且A元素的最高正价与最低负价和为零,C是同周期中原子半径最大的元素,D是同周期中离子半径最小的元素。C的单质在加热条件下与B的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物F。试根据以上叙述回答:
(1)D元素在周期表中位置为_____________________;
(2)画出E的离子结构示意图_____________;写出ABE分子的结构式____________;
(3)工业上常用在微波条件下用A单质与EB2反应来解决其产生的环境问题,写出该化学方程式:___________________________________________;
(4)用电子式表示C2E的形成过程__________________________________________;
(5)1 mol F与A元素的最高价氧化物反应时转移的电子数为_________。
【答案】 第三周期IIIA族  S=C=O C+SO2
S=C=O C+SO2![]() CO2+S
CO2+S ![]() NA或6.02×1023
NA或6.02×1023
【解析】试题分析:本题考查元素的推断,元素在周期表中的位置,离子结构示意图、结构式、电子式等化学用语的书写,氧化还原反应中转移电子数的计算。A元素的最高正价与最低负价和为零,A为第IVA族元素;C是同周期中原子半径最大的元素,C为第IA族元素;A、B、C、D、E都是短周期元素且原子序数依次增大,A为C元素,C为Na元素;D是同周期中离子半径最小的元素,D为Al元素;E单质为淡黄色固体,E为S元素;A和B原子具有相同的电子层数,C的单质在加热条件下与B的单质充分反应得到淡黄色固态化合物F,B为O元素,F为Na2O2。
(1)D为Al元素,Al元素在周期表中位置为第三周期IIIA族。
(2)E为S元素,E的离子为S2-,S2-的结构示意图为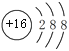 。ABE的分子式为COS,COS的结构式为O=C=S。
。ABE的分子式为COS,COS的结构式为O=C=S。
(3)EB2为SO2,SO2引起的典型环境问题是酸雨,在微波条件下A单质(C)与SO2反应解决SO2产生的环境问题,C与SO2反应生成CO2和S,该反应的方程式为:C+SO2![]() CO2+S。
CO2+S。
(4)C2E为Na2S,Na2S中只存在离子键,用电子式表示Na2S的形成过程为:![]() 。
。
(5)A的最高价氧化物为CO2,F与CO2反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,用双线桥分析该反应为: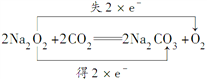 ,1molNa2O2反应转移1mol电子,转移电子数为NA或6.02
,1molNa2O2反应转移1mol电子,转移电子数为NA或6.02![]() 1023。
1023。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】由CO2、H2O(g)组成的混合气体共a mol,其中CO2的物质的量分数为x.将该混合气体缓慢通过装有1mol Na2O2的真空管,充分反应后,维持120℃、1.01×105Pa.收集所得气体,冷却、称量,真空管中固体质量增加y g.
(1)若a=1,则y=(用含x代数式表示);
(2)若a=2,x=0.5时,反应后所得气体的成份是;
(3)若a=2,y=28时,则x的取值范围;
(4)若a=1.25,试作出y与x的关系曲线,并在y轴标明曲线起点和终点的数值.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,又是一种可再生资源,具有开发和应用的广阔前景.
(1)已知: CH3OH(g)=HCHO(g)+H2(g)△H=+84kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=﹣484kJ/mol
①工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式: .
②在上述制备甲醛时,常向反应器中通入适当过量的氧气,其目的是 .
(2)工业上可用如下方法合成甲醛,化学方程式为CO(g)+2H2(g)=CH3OH(g),已知某些化学键的键能数据如下表:
化学键 | C﹣C | C﹣H | H﹣H | C﹣O | C≡O | O﹣H |
键能/kJ/mol | 348 | 413 | 436 | 358 | x | 463 |
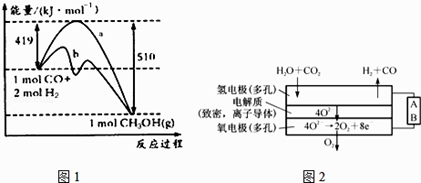
请回答下列问题:
①如图中曲线a到曲线b的措施是 .
②已知CO中的C与O之间为三键,其键能为xkJ/mol,则x=
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电. ①该电池正极的电极反应式为 .
②若以该电池为电源,用石墨作电极电解200mL含有如下离子的溶液.
离子 | Cu2+ | H+ | Cl﹣ | SO42﹣ |
c/mol/L | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶液现象)阳极上收集到氧气的质量为 .
(4)电解水蒸气和CO2产生合成气(H2+CO),较高温度下(700﹣1000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2﹣ , O2﹣穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2 . 由右图可知A为直流电源的(填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.纯净物一定由分子构成
B.混合物肯定由两种以上元素组成
C.同种分子构成的物质一定是纯净物
D.含有氧元素的化合物都是氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y 各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如下表,下列说法正确的是( )
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率v(Z)=2.0×10﹣3 mol/(Lmin)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的溶液,造成浓度偏高的操作是
A.定容时,滴加蒸馏水超过刻度线
B.定容时,眼睛俯视刻度线
C.洗涤烧杯和玻璃棒的溶液未转入容量瓶中
D.定容时,眼睛仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
![]()
①写出由纯SiHCl3制备高纯硅的化学反应方程式_____________________________。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、H2和另一种酸,写出并配平化学反应方程式_________________________________;H2还原SiHCl3过程中若混入O2,可能引起的后果是_________________________________________________。
(2)下列有关硅材料的说法正确的是________ 。
A.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高,硬度很大
(3)自然界中硅酸盐种类多,结构复杂,通常用二氧化硅和金属氧化物的形式来表示其组成.如正长石(KAlSi3O8),氧化物形式为_________________________________
(4)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入稀硝酸,产生的实验现象为_____________,水玻璃在工业上有许多用途,试举出一例____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com