
| A. | 铁与稀硫酸反应 | B. | 灼热的碳与CO2的反应 | ||
| C. | Ba(OH)2•8H2O与NH4Cl的反应 | D. | 乙烷在氧气中的燃烧反应 |
科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 3 | C. | 2 | D. | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡常数减小 | B. | BaO量不变 | C. | 氧气浓度不变 | D. | 平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,1L一氧化碳气体一定比1L氧气的质量小 | |
| B. | 任何条件下,等物质的量的甲烷(CH4)和一氧化碳所含的原子数一定相等 | |
| C. | 同温同压下的二氧化碳气体和氮气,若体积相等,则质量一定相等 | |
| D. | 同温同压下,相同体积的气体,其分子数一定相等,原子数也一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,增大反应物的量会加快化学反应速率 | |
| B. | 增大压强,肯定会加快化学反应速率 | |
| C. | 构成物质微粒间的化学键键能越小,该物质的能量就越低,物质越稳定 | |
| D. | 升高温度能使单位体积内的活化分子数增加,从而增大化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装时期 | |
| 分装企业 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F、G是原子序数依次递增的短周期元素,已知A和D,C和F为同一主族元素,A与B、A与G形成共价化合物,B原子的最外层电子数比次外层多3,G元素的最高正化合价与最低负化合价的代数和为6,E是同周期中离子半径最小的元素,F形成的化合物是造成酸雨的主要原因.请回答下列问题:
已知A、B、C、D、E、F、G是原子序数依次递增的短周期元素,已知A和D,C和F为同一主族元素,A与B、A与G形成共价化合物,B原子的最外层电子数比次外层多3,G元素的最高正化合价与最低负化合价的代数和为6,E是同周期中离子半径最小的元素,F形成的化合物是造成酸雨的主要原因.请回答下列问题: .画出G离子的结构示意图
.画出G离子的结构示意图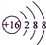 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com