
分析 (1)K为生成物浓度幂之积与反应物浓度幂之积的比,纯固体不能代入K的表达式中,反应遵循质量守恒定律;
(2)在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,浓度分别为$\frac{2mol}{0.5mol}$=4mol/L、$\frac{1mol}{0.5mol}$=2mol/L、$\frac{2mol}{0.5mol}$=4mol/L,Qc=$\frac{{4}^{2}}{4×{2}^{3}}$=0.5=K,平衡不移动;
欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可增大压强使平衡正向移动,以此来解答.
解答 解:(1)K为生成物浓度幂之积与反应物浓度幂之积的比,由K的表达式及质量守恒定律可知反应为C(s)+H2O(g)?H2(g)+CO(g),
故答案为:C(s)+H2O(g)?H2(g)+CO(g);
(2)在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,浓度分别为$\frac{2mol}{0.5mol}$=4mol/L、$\frac{1mol}{0.5mol}$=2mol/L、$\frac{2mol}{0.5mol}$=4mol/L,Qc=$\frac{{4}^{2}}{4×{2}^{3}}$=0.5=K,平衡不移动,可知此时反应V(N2)正=V(N2)逆,
A、缩小体积增大压强,反应速率增大,且平衡正向移动,NH3的体积百分数增加,故A选;
B、该反应为放热反应,升高温度,平衡逆向移动,NH3的体积百分数减小,故B不选;
C、加催化剂,平衡不移动,NH3的体积百分数不变,故C不选;
D、使氨气液化移走,生成物浓度减小,反应速率减小,故D不选;
故答案为:=;A.
点评 本题考查化学平衡的计算,为高频考点,把握浓度商与K的关系及平衡移动为解答的关键,侧重分析与应用能力的考查,注意K的表达式及方程式的书写,题目难度不大.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:实验题
| 化学键 | N≡N | H-O | O-O | H-N |
| E/kJ•mol-1 | a | b | c | d |
| 实验编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
| N(SO2) | N(NO2) | N(NO) | ||
| 甲 | T1 | 0.80 | 0.20 | 0.18 |
| 乙 | T2 | 0.20 | 0.80 | 0.16 |
| 丙 | T3 | 0.20 | 0.30 | a |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+ Na+ Cl- SO42- | B. | K+ Na+ CO32- NO3- | ||
| C. | K+ Na+ Cl- Cu2+ | D. | Na+Ba2+OH- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.
氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
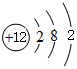 ,⑤
,⑤ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe3+、K+、ClO- 都可在该物质的溶液中大量共存 | |
| B. | 检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色 | |
| C. | 向0.1mol•L-1该物质的溶液中逐滴滴加0.1mol•L-1NaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如上图所示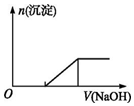 | |
| D. | 向该物质的溶液中滴加Ba(OH)2溶液,恰好使SO42-完全沉淀的离子方程式为:Fe2++2SO42-+2Ba2++2OH-═2BaSO4↓+Fe(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFe溶于过量硝酸,电子转移数为2NA | |
| B. | 1mol O2和2mol SO2反应生成的SO3分子数为2NA | |
| C. | 常温常压下,4.4gCO2与N2O混合气体中含有的原子数为0.3NA | |
| D. | H2O2分解产生1molO2,转移的电子数为4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com