
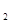
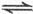 N
N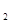 O
O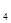 ,下列不能说明反应达到了平衡状态的是
,下列不能说明反应达到了平衡状态的是A.N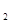 O O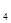 生成速率与N 生成速率与N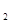 O O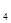 分解速率相等时 分解速率相等时 |
| B.混合气体平均相对分子质量保持不变时 |
C.NO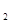 的分子数与N 的分子数与N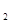 O O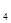 分子数比为2:1时 分子数比为2:1时 |
| D.体系颜色不再发生改变时 |


科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
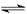 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
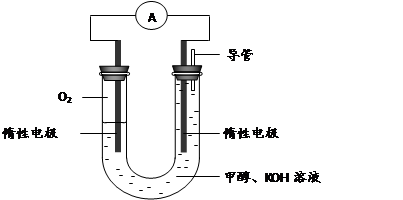
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
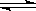 nC(g)的反应体系中,C的百分含量(c%)与时间t的曲线如右图所示,下面结论正确的是
nC(g)的反应体系中,C的百分含量(c%)与时间t的曲线如右图所示,下面结论正确的是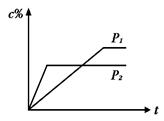
| A.P1>P2,n<3 | B.P1<P2,n>3 |
| C.P1>P2,n>3 | D.P1<P2,n<3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g)+D(g),其中a为正整数。反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是
2C(g)+D(g),其中a为正整数。反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是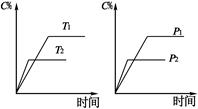
| A.达到平衡后,加入催化剂,则C%增大 |
| B.达到平衡后,若升高温度,平衡向右移动 |
| C.a可以为任意正整数 |
| D.达平衡后,增加A的量,有利于平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 HClO+OH-,下列措施能提高其漂白效益的是( )
HClO+OH-,下列措施能提高其漂白效益的是( )| A.加水稀释 | B.通入CO2 | C.加适量盐酸 | D.加少量NaHCO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
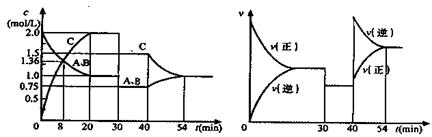
| A.在30min时降低温度,40min时升高温度 |
| B.8min前A的平均反应速率为0.08 mol·L-1·min-1 |
| C.反应方程式中的x=1,正反应为放热反应 |
| D.20min~40min间该反应的平衡常数均为4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 N2O4(g) ΔH<0。现将NO2和N2O4 混合气体通入恒温密闭容器中,反应中物质浓度随时间的变化如图。下列说法正确的是
N2O4(g) ΔH<0。现将NO2和N2O4 混合气体通入恒温密闭容器中,反应中物质浓度随时间的变化如图。下列说法正确的是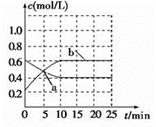
| A.a点表示反应处于平衡状态 |
| B.25 min末,若增大压强,化学平衡常数增大 |
| C.25 min末,若升高温度,NO2的体积分数减小 |
| D.10min内用N2O4表示的平均速率为0.02mol·L-1·min-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g)(正反应放热)中,为了增大A的转化率,应采用的反应条件是( )
2C(g)(正反应放热)中,为了增大A的转化率,应采用的反应条件是( )| A.高温、高压 | B.高温、低压 | C.适当温度、高压 | D.低温、低压 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com