
【题目】25 ℃时,用浓度为0.1000 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.1000 mol·L-1的三种酸HX、HY、HZ,滴定曲线如下图所示。下列说法错误的是
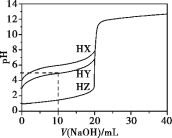
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HX<HY<HZ
B.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+)
C.根据滴定曲线,可得知Y-的水解常数K约为10-9
D.由图象可知酸碱中和滴定分析不适用于极弱的酸和极弱的碱的测定
【答案】B
【解析】
A.在没有滴加NaOH溶液时,浓度均为0.1000 mol·L-1的三种酸HX、HY、HZ的pH分别为4、3、1,三种酸的酸性HX<HY<HZ,故浓度均为0.1000 mol·L-1的三种酸HX、HY、HZ的导电能力顺序:HX<HY<HZ,A正确;
B.因为HY的酸性强于HX,所以HX恰好完全反应时,HY早已反应完全,所得溶液为NaX和NaY混合溶液,相同情况下酸越弱,酸根离子的水解程度越大,所以X-的水解程度大于Y-的水解程度,故溶液中c(Y-)>c(X-),B错误;
C.HY![]() H++Y-,0.1000 mol·L-1HY溶液的pH等于3,c(H+)=1.0×10-3mol·L-1,c(Y-)与c(H+)大致相同,Ka(HY)=
H++Y-,0.1000 mol·L-1HY溶液的pH等于3,c(H+)=1.0×10-3mol·L-1,c(Y-)与c(H+)大致相同,Ka(HY)=![]() ,Y-的水解常数K约为
,Y-的水解常数K约为![]() ,C正确;
,C正确;
D.由图象可知酸碱中和滴定时,酸越弱滴定终点时突跃范围越不明显,故酸碱中和滴定分析不适用于极弱的酸和极弱的碱的测定,D正确;
答案选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】 ClO2是一种强氧化性气体,在消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过如图所示装置对其进行制备、收集、吸收并制取NaClO2。

(1)仪器A的名称是________。
(2)图中装置有一明显错误,请指出:________。
(3)打开B的活塞,A中有ClO2生成,D中吸收ClO2后生成NaClO2和NaHCO3,写出D中所发生反应的离子方程式:________。
(4)E中溶液出现黄色能否说明ClO2未被H2O2和Na2CO3的混合溶液充分吸收,判断并说明理由:________。
(5)写出一种提高ClO2吸收率的方法:________。
(6)E装置吸收逸出的少量ClO2气体后所得溶液(pH为5.5~6.5)中存在少量ClO2-,当pH≤2时,ClO2-能被I还原。请补充完整检验E装置溶液中存在少量ClO2-的实验方案:取一定体积E装置中的溶液于分液漏斗中,________,则溶液中存在ClO2-。(实验中须使用的试剂有:CCl4、稀硫酸、淀粉溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素R的气态氢化物化学式为HxR.在标准状况下,8.5gHxR气体的体积是5.6L。将5.1gHxR气体通入200mL0.75mol/L的CuCl2溶液中正好完全反应,并生成黑色沉淀。
(1)求HxR的式量; (2)推断x值,并确定R元素的名称。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】艾司洛尔是预防和治疗手术期心动过速或高血压的一种药物,艾司洛尔的一种合成路线如下:

回答下列问题:
(1)丙二酸的结构简式为_______;E中含氧官能团的名称是_______。
(2)D生成E的反应类型为____________。
(3)C的结构简式为________________。
(4)A遇FeCl3溶液发生显色反应,1 mol A和1 mol丙二酸在吡啶、苯胺中反应生成1 mol B、1 mol H2O和1 mol CO2,B能与溴水发生加成反应,推测A生成B的化学方程式为____。
(5)X是B的同分异构体,X同时满足下列条件的结构共有____种,其中核磁共振氢谱有五组峰的结构简式为____。
①可与碳酸氢钠溶液反应生成二氧化碳
②遇FeCl3溶液发生显色反应
③除苯环外不含其他环
(6)写出以苯甲醇和丙二酸为原料制备![]() 的合成路线________(其他试剂任选)。
的合成路线________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3. 84 g铜粉与一定质量浓硝酸反应,当铜完全作用时,溶液中的NO3-减少0.1mol,则所消耗硝酸的物质的量是
A.0.1 molB.0.11 molC.0.16 molD.0.22 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化硼(BP)是一种受到高度关注的金属保护层耐磨材料,可由三溴化硼和三溴化磷在氢气中高温制得。
(1)合成BP的反应中,基态原子未成对电子最多的元素符号为____,核外电子数最多的元素的基态原子电子占据最高能级上的电子数为____。B所在的周期第一电离能最大的元素名称为____。
(2)三溴化磷分子的中心原子价层电子对数为____,分子空间结构为____形。BBr3空间结构为____形,PBr3分子中键角比BBr3分子中键角____(填>、<或=)。
(3)N与P同主族。科学家在一定条件下把氮气(氮氮三键键能为942kJmol-1)聚合为固体高聚氮,全部以N-N键相连且键能为160kJmol-1,这种固体高聚氮可能潜在的用途是____,这是因为____。
(4)BP晶胞,磷原子在晶胞中采用金属铜原子的堆积方式,硼原子填充在其四面体空隙中,则其四面体填充率为____,已知晶胞参数a=478pm,则硼和磷原子的核间距为____pm(保留整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)书写浓硫酸与木炭在加热条件下的化学方程式为__________。
(2)试用下列各装置设计一个实验,验证上述反应所产生的各种产物。 这些装置的连接顺序(按产物气流从左到右的方向)是(填装置的编号):__________→__________→__________→__________。
(3)实验时可观察到装置①中A瓶的溶液褪色,证明___________,B瓶溶液的作用____________,C瓶的溶液有___________现象,证明____________。
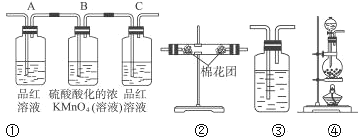
(4)书写B中的离子方程式____________。B中放置溴水不如高锰酸钾的原因____________________________。
(5)装置③中所盛溶液是__________,可验证的产物是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着我国汽车年销量的大幅增加,给空气环境造成了很大的污染。汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )

A. 反应中NO为氧化剂,N2为氧化产物
B. 汽车尾气的主要污染成分包括CO、NO和N2
C. NO和O2必须在催化剂表面才能反应
D. 催化转化总化学方程式为2NO+O2+4CO ![]() 4CO2+N2
4CO2+N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:则CH4的燃烧热为( )
![]() CH4(g)+O2(g)=
CH4(g)+O2(g)= ![]() CO2(g)+H2O(l) ΔH=-445.15 kJ·mol-1
CO2(g)+H2O(l) ΔH=-445.15 kJ·mol-1
CH4(g)+![]() O2(g)=CO(g)+2H2O(l) ΔH=-607.3 kJ·mol-1
O2(g)=CO(g)+2H2O(l) ΔH=-607.3 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802.3 kJ·mol-1
A.445.15 kJ·mol-1B.890.3 kJ·mol-1
C.607.3 kJ·mol-1D.802.3 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com