
| A. | 除去MgCl2溶液中少量的FeCl3,可选用MgCO3 | |
| B. | 等物质的量浓度的(NH4)2SO4溶液和(NH4)2CO3溶液中NH4+的浓度前者大于后者 | |
| C. | NaHS溶液中,滴入少量CuCl2溶液,产生黑色沉淀,HS-的水解程度增大,pH增大 | |
| D. | 用饱和氯化铵溶液可以清洗金属表面的锈迹 |
分析 A、FeCl3易水解生成氢氧化铁,加入Mg(OH)2粉末、MgO或MgCO3,调节溶液的pH,促进铁离子的水解,且不引入新的杂质;
B、(NH4)2CO3溶液中碳酸根离子的水解对铵根离子的水解起促进作用;
C、在NaHS溶液中存在HS-?H++S2-,加入CuCl2溶液铜离子与硫离子结合生成硫化铜,导致硫离子浓度减少,促进电离;
D、饱和氯化铵溶液显酸性.
解答 解:A、FeCl3易水解生成氢氧化铁,加入Mg(OH)2粉末、MgO或MgCO3,调节溶液的pH,促进铁离子的水解,且不引入新的杂质,故A正确;
B、(NH4)2CO3溶液中碳酸根离子的水解对铵根离子的水解起促进作用,所以等物质的量浓度的(NH4)2SO4溶液和(NH4)2CO3溶液中NH4+的浓度前者大于后者,故B正确;
C、在NaHS溶液中存在HS-?H++S2-,加入CuCl2溶液铜离子与硫离子结合生成硫化铜,导致硫离子浓度减少,促进电离,氢离子的浓度增大,溶液的PH减小,故C错误;
D、饱和氯化铵溶液中铵根离子水解显酸性,能溶解金属氧化物,所以用饱和氯化铵溶液可以清洗金属表面的锈迹,故D正确;
故选C.
点评 本题主要考查了除杂,盐类的水解、电离平衡的移动等知识,综合性强,但比较容易,学生注意除杂时不能引入新杂质.


科目:高中化学 来源: 题型:选择题
| A. | 无色气体,难溶于水,密度比空气略小 | |
| B. | 乙烯燃烧时,火焰明亮,同时产生黑烟 | |
| C. | 与溴水发生取代反应而使溴水褪色 | |
| D. | 乙烯的产量标志着一个国家的石油化工水平 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试样 | 所加试剂 | 实验现象 |
| 第一份试液 | 滴加适量的淀粉KI溶液 | 呈蓝色 |
| 第二份试液 | 滴加用盐酸酸化的BaCl2溶液 | 有白色沉淀 |
| 第三份试液 | 滴加NaOH溶液,加热,加入的NaOH溶液体积(V)与生成的沉淀、产生的气体(n)的关系如右图 |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
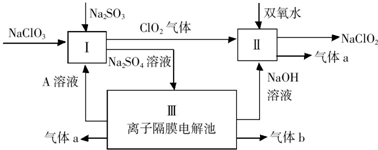
 ;Ⅰ中发生反应的还原剂是Na2SO3(填化学式).
;Ⅰ中发生反应的还原剂是Na2SO3(填化学式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2与NaHCO3 | B. | SiO2与Na2CO3 | C. | SiO2 | D. | Na2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 A、B、C均为短周期元素,它们在周期表中的位置如图.已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C所在的一组元素是( )
A、B、C均为短周期元素,它们在周期表中的位置如图.已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C所在的一组元素是( )| A. | Be、Na、Al | B. | B、Mg、Si | C. | C、Al、P | D. | O、P、Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$ +2Ag↓+3NH3+H2O或
+2Ag↓+3NH3+H2O或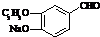 +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$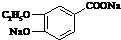 +Cu2O↓+3H2O.
+Cu2O↓+3H2O. .
.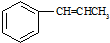 合成
合成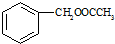 合成路线流程图示例如下:
合成路线流程图示例如下: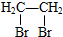
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com