
| A. | 常温常压下,11.2L CO2与8.5g NH3所含分子数相等 | |
| B. | 等质量的H3O+和OH-质子数之比与电子数之比相同 | |
| C. | 同温同压下,相同体积的H2和CO2的原子数之比为2:3 | |
| D. | 同温同压下,相同质量的NO和C2H4(气体)体积相同 |
分析 A、常温常压下,气体的摩尔体积不知;
B、等质量的H3O+和OH-,物质的量之比为:$\frac{1}{19}:\frac{1}{17}$=17:19,设H3O+物质的量为17mol则OH-物质的量为19mol,则OH-具有9×17个质子,10×17个电子,而H3O+中具有11×19个质子,10×19个电子;
C、同温同压下,相同体积的H2和CO2的物质的量相等,所以原子数之比2:3;
D、相同质量的NO和C2H4(气体)两者的物质的量不相等.
解答 解:A、常温常压下,气体的摩尔体积不知,所以分子数是否相等不知,故A错误;
B、等质量的H3O+和OH-,物质的量之比为:$\frac{1}{19}:\frac{1}{17}$=17:19,设H3O+物质的量为17mol则OH-物质的量为19mol,则OH-具有9×17个质子,10×17个电子,而H3O+中具有11×19个质子,10×19个电子,他们质子数之比与电子数之比分别为:9:10和11:10,不相等,故B错误;
C、同温同压下,相同体积的H2和CO2的物质的量相等,所以原子数之比2:3,故C正确;
D、相同质量的NO和C2H4(气体)两者的物质的量不相等,所以同温同压下体积不相同,故D错误;
故选C.
点评 本题考查了物质的量的相关计算以及质子数和电子数的计算,难度不大,明确阴阳离子中电子数和质子数的关系是解本题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 将铝粉投入溶液中会产生氢气:Mg2+、NO3-、K+、SO42- | |
| B. | 滴加石蕊试液会使溶液变蓝:Na+、Al3+、CO32-、NO3- | |
| C. | 将锌粒投入溶液中会产生氢气:Ca2+、Cl-、Mg2+、NH4+ | |
| D. | 溶液能使淀粉碘化钾试纸变蓝NH4+、CO32-、Cl-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时NH4Cl溶液的Kw大于100℃时NH4Cl溶液的Kw | |
| B. | SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O═SO42-+2I- | |
| C. | 加入铝粉能产生氢气的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3- | |
| D. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;实验室制备气体A的化学方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用离子方程式表示)
;实验室制备气体A的化学方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用离子方程式表示)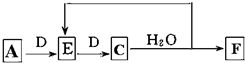
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
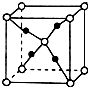 X、Y、Z、R是元素周期表中前四周期中的常见元素.X的单质是密度最小的气体;Y的一种核素常用于考古,且其一种同素异形体是较软的物质之一;Z的气态氢化物与其最高价氧化物的水化物相遇会产生大量白烟;R2+离子的3d轨道有9个电子.(答题时用具体的元素符号)
X、Y、Z、R是元素周期表中前四周期中的常见元素.X的单质是密度最小的气体;Y的一种核素常用于考古,且其一种同素异形体是较软的物质之一;Z的气态氢化物与其最高价氧化物的水化物相遇会产生大量白烟;R2+离子的3d轨道有9个电子.(答题时用具体的元素符号)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
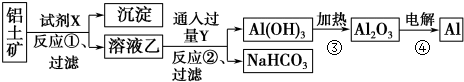
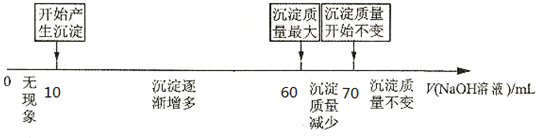
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 | |
| B. | 任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 | |
| C. | 已知:①2H2(g)+O2(g)═2H2O(g)△H1②2H2(g)+O2(g)=2H2O(1)△H2,则△H1<△2 | |
| D. | 已知:①C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJ•mol-1,②C(s,金刚石)+O2(g)═CO2(g)△H=-395.0 kJ•mol-1 则C(s,石墨)=C(s,金刚石)△H=-1.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com