
下列指定反应的离子方程式正确的是
A.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42-恰好沉淀完全:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO+2H2O
B.向苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
C.氧化亚铁溶于稀硝酸: 3FeO + 8H+ + NO3-=3Fe3+ + NO↑+ 4H2O
3FeO + 8H+ + NO3-=3Fe3+ + NO↑+ 4H2O
D.4 mol·L-1的NaAlO2溶液和7 mol·L-1的盐酸等体积混合:4AlO2-+7H++H2O=3Al(OH)3↓+Al3+
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源:2014-2015黑龙江省高二上学期期末考试化学试卷(解析版) 题型:选择题
把0.05molNaOH固体分别加入下列100mL溶液中,溶液的导电能力变化不大的是
A.自来水 B.0.5mol·L—1KOH溶液
C.0.5mol·L—1醋酸 D.0.5mol·L—1NH4Cl溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市顺义区高三第一次统一练习化学试卷(解析版) 题型:填空题
(12分)6种相邻短周期主族元素的相对位置如下表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍。用化学用语回答下列问题:
X | Y | Z | |
W | M | Q |
(1)Y在周期表中的位置是________。
(2)X、Y、Z三种元素的原子半径由大到小的顺序是________。
(3)W、M、Q三种元素最高价氧化物对应的水化物中,酸性由强到弱的顺序是________。
(4)W的最高价氧化物可以和Z的氢化物反应,利用该反应可刻蚀玻璃,反应的化学方程式是________。
(5)X的含10个电子 的气态氢化物甲是一种重要的化工原料。甲的电子式是 ,实验室制备甲的化学方程式是________,甲可以与X的最高价氧化物对应的水化物溶液反应生成盐乙,乙溶液中的离子浓度由大到小的顺序是 。X的含18个电子的气态氢化物丙可与空气构成一种环保型碱性燃料电池,电池工作时丙发生的电极反应方程式是 。
(6)工业上用下图所示装置电解Q元素的钠盐溶液丁,获得一种含Q元素的消毒剂。该反应的离子方程式是 。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省扬州市高三上学期期末考试化学试卷(解析版) 题型:实验题
(16分)高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下:
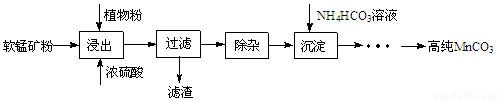
(1)浸出:浸出时温度控制在90℃~95℃之间,并且要连续搅拌3小时的目的是 ,植物粉的作用是 。
(2)除杂:①向浸出液中加入一定量的碳酸锰矿,调节浸出液的pH为3.5~5.5;
②再加入一定量的软锰矿和双氧水,过滤;
③…
操作①中使用碳酸锰调pH的优势是 ;操作②中加入双氧水不仅能将Fe2+氧化为Fe3+,而且能提高软锰矿的浸出率。写出双氧水提高软锰矿浸出率的离子方程式 。
(3)制备:在30 ℃~35 ℃下, 将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到MnCO3沉淀。温度控制35 ℃以下的原因是 ;该反应的化学方程式为 ;生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是 。
(4)计算:室温下,Ksp(MnCO3)=1.8×10-11,Ksp(MgCO 3)=2.6×10-5 ,已知离子浓度小于1.0×10-5mol·L-1时,表示该离子沉淀完全。若净化液中的c(Mg2+)=10-2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度。
3)=2.6×10-5 ,已知离子浓度小于1.0×10-5mol·L-1时,表示该离子沉淀完全。若净化液中的c(Mg2+)=10-2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省扬州市高三上学期期末考试化学试卷(解析版) 题型:选择题
某药物中间体的合成路线如下。下列说法正确的是
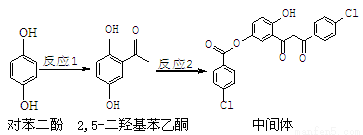
A.对苯二酚在空气中能稳定存在
B.1 mol该中间体最多可与11 mol H2反应
C.2,5-二羟基苯乙酮能发生加成、水解、缩聚反应
D.该中间体分子中含有1个手性碳原子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省扬州市高三上学期期末考试化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.HClO的结构式:H—Cl—O
B.羟基的电子式:
C.NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32-
D.异丙醇的结构简式:CH3CH2CH2OH[来
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三4月质量检查理综化学试卷(解析版) 题型:选择题
下列工业生产的主要反应中,涉及置换反应的是
A.制取粗硅 B.海水提镁 C.电解制铝 D.制备硫酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省新校高三4月模拟化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】(15分)Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用。
(1)与N3-含有相同电子数的三原子分子的空间构型是 。
(2)Cu具有良好的导电、导热和延展性,请解释Cu具有导电性的原因 。
(3)在Cu的催化作用下,乙醇可被空气氧化为乙醛,乙醛分子中碳原子的杂化方式是__________,乙醛分子中H—C—O的键角__________乙醇分子中的H—C—O的键角(填“大于”、“等于”或“小于”)。
(4)Cu+的核外电子排布式为 ,其在酸性溶液中不稳定,可发生歧化反应生成Cu2+和Cu,但CuO在高温下会分解成Cu2O,试从结构角度解释高温下CuO为何会生成Cu2O 。
(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,试画出[Cu(H2O)2(Cl)2]具有极性的分子的结构式 。
(6)Cu3N的晶胞结构如图,N3-的配位数为__________,Cu+半径为a pm,N3-半径为b pm,Cu3N的密度__________g/cm3。(阿伏加德罗为常数用NA表示)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com