
 某无色透明溶液只可能含有Ba2+、NH4+、K+、Al3+、Fe 3+、Cl-、SO42-离子中的几种
某无色透明溶液只可能含有Ba2+、NH4+、K+、Al3+、Fe 3+、Cl-、SO42-离子中的几种| n |
| V |
| 0.06mol |
| 0.06L |
| n |
| V |
| 0.01mol |
| 0.01L |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 工业上测量SO2、N2、O2混合气体中SO2含量的装置如图.反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O═H2SO4+2HI
工业上测量SO2、N2、O2混合气体中SO2含量的装置如图.反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O═H2SO4+2HI查看答案和解析>>
科目:高中化学 来源: 题型:
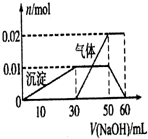
 有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则原混合溶液中Cl-与SO42-的物质的量之比为( )
有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则原混合溶液中Cl-与SO42-的物质的量之比为( )| A、1:1 | B、2:1 |
| C、3:2 | D、2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是制取、干燥和收集某气体的实验装置,可用于( )
如图是制取、干燥和收集某气体的实验装置,可用于( )| A、用Zn与稀H2SO4反应制H2 |
| B、用CaO与浓氨水反应制NH3 |
| C、用Cu与稀HNO3反应制NO |
| D、用MnO2与浓HCl反应制C12 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、W四种物质之间有如右图所示的转化关系(部分物质未写全),且已知反应热之间的关系符合等式:△H=△H1+△H2,符合上述要求的X、Y可能是①S、SO2 ②AlCl3、Al(OH)3 ③CH2=CH2、CH3CH3 ④CH3OH、HCHO.
X、Y、Z、W四种物质之间有如右图所示的转化关系(部分物质未写全),且已知反应热之间的关系符合等式:△H=△H1+△H2,符合上述要求的X、Y可能是①S、SO2 ②AlCl3、Al(OH)3 ③CH2=CH2、CH3CH3 ④CH3OH、HCHO.| A、①② | B、②③ | C、②④ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将pH试纸直接放在某溶液中,测试该溶液的pH |
| B、分液操作时,先将下层液体从下口放出,然后再换个烧杯将上层液体从下口放出 |
| C、过滤操作时,漏斗下端的尖嘴要紧靠烧杯的内壁 |
| D、用乙醇作萃取剂从碘水中提取碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
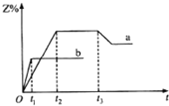 一密闭容器中加入相同物质的量的X和Y气体,发生反应:X(g)+Y(g)?3Z(g).分别在100℃和300℃反应时Z的体积分数Z%随时间t变化如图所示.已知在t3时改变了某一反应条件.则相关判断正确的是( )
一密闭容器中加入相同物质的量的X和Y气体,发生反应:X(g)+Y(g)?3Z(g).分别在100℃和300℃反应时Z的体积分数Z%随时间t变化如图所示.已知在t3时改变了某一反应条件.则相关判断正确的是( )| A、曲线b表示的是l00℃时的图象 |
| B、该反应的正反应是吸热反应 |
| C、t2时,曲线a、b对应反应速率v(a)>v(b) |
| D、t3时改变的条件可能是增大了压强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com