
已知下列各组反应,对应的离子方程式正确的是 ( )
A、钠与水反应:Na+H2O=Na++OH-+H2↑
B、氯气和氯化亚铁反应:Cl2+Fe2+=2Cl-+Fe3+
C、铝与硝酸铜反应:Al+Cu2+=Cu+Al3+
D、FeCl3溶液与铜单质反应:2Fe3++Cu=Cu2++2Fe2+
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH | 加碱溶解的pH |
| Fe2+ | 7.6 | 9.7 | |
| Fe3+ | 2.7 | 3.7 | |
| Al3+ | 3.8 | 4.7 | >8.5 |
| Mn2+ | 8.3 | 9.8 |
查看答案和解析>>
科目:高中化学 来源:河北省衡水中学2011-2012学年高一下学期三调考试化学试题 题型:022
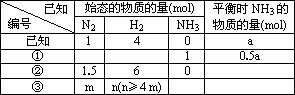
在一个盛有催化剂容积可变的密闭容器中,保持一定的温度和压强,进行以下反应:N2+3H2?2NH3已知加入1 mol N2、4 mol H2时,达到平衡后生成a mol NH3(见表中已知项),在相同温度和压强下保持平衡后各组分体积分数不变,对下列编号①~③的状态,填写表中空白.
查看答案和解析>>
科目:高中化学 来源: 题型:
(7分)在一个盛有催化剂容积可变的密闭容器中,保持一定的温度和压强,进行以下反应:N2+3H2⇌2NH3已知加入1 mol N2、4 mol H2时,达到平衡后生成a mol NH3(见表中已知项),在相同温度和压强下保持平衡后各组分体积分数不变,对下列编号①~③的状态,填写表中空白。
| 已知编号 | 始态的物质的量(mol) | 平衡时NH3的 物质的量(mol) | ||
| N2 | H2 | NH3 | ||
| 已知 | 1 | 4 | 0 | a |
| ① |
|
| 1 | 0.5a |
| ② | 1.5 | 6 | 0 |
|
| ③ | m | n( n≥4m) |
|
|
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省衡水中学高一下学期三调考试化学试卷 (带解析) 题型:填空题
(7分)在一个盛有催化剂容积可变的密闭容器中,保持一定的温度和压强,进行以下反应:N2+3H2?2NH3已知加入1 mol N2、4 mol H2时,达到平衡后生成a mol NH3(见表中已知项),在相同温度和压强下保持平衡后各组分体积分数不变,对下列编号①~③的状态,填写表中空白。
| 已知编号 | 始态的物质的量(mol) | 平衡时NH3的 物质的量(mol) | ||
| N2 | H2 | NH3 | ||
| 已知 | 1 | 4 | 0 | a |
| ① | | | 1 | 0.5a |
| ② | 1.5 | 6 | 0 | |
| ③ | m | n( n≥4m) | | |
查看答案和解析>>
科目:高中化学 来源:2014届河北省高一下学期三调考试化学试卷(解析版) 题型:填空题
(7分)在一个盛有催化剂容积可变的密闭容器中,保持一定的温度和压强,进行以下反应:N2+3H2⇌2NH3已知加入1 mol N2、4 mol H2时,达到平衡后生成a mol NH3(见表中已知项),在相同温度和压强下保持平衡后各组分体积分数不变,对下列编号①~③的状态,填写表中空白。
|
已知编号 |
始态的物质的量(mol) |
平衡时NH3的 物质的量(mol) |
||
|
N2 |
H2 |
NH3 |
||
|
已知 |
1 |
4 |
0 |
a |
|
① |
|
|
1 |
0.5a |
|
② |
1.5 |
6 |
0 |
|
|
③ |
m |
n( n≥4m) |
|
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com