
| A、1mol食盐含有6.02×1023个分子 |
| B、Mg的摩尔质量为24 |
| C、1mol水中含有2mol氢和1mol氧 |
| D、1molNe含有6.02×1024个电子 |


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3 |
| B、Na |
| C、Na2O2 |
| D、Na2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在101 kPa时,1molCH4完全燃烧生成CO2和水蒸气放出的热量就是CH4的燃烧热 |
| B、除去苯中混有的苯酚,可滴加浓溴水,再经过滤除去 |
C、已知:C-C、C=C、C-H、H-H键能分别为348,610,413,436(单位均为kJ/mol)则可以计算出反应 的△H为-384 kJ/mol 的△H为-384 kJ/mol |
| D、含1mol NaOH的稀溶液分别和含1mol CH3COOH、1molHNO3的稀溶液反应,前者比后者放出的热量少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
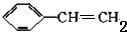 ,将ag聚苯乙烯树脂溶于bg苯中,然后通入 cmol乙炔气体,则充分混合后,所得产物中C、H两种元素的质量比是( )
,将ag聚苯乙烯树脂溶于bg苯中,然后通入 cmol乙炔气体,则充分混合后,所得产物中C、H两种元素的质量比是( )| A、12:1 | B、6:1 |
| C、8:3 | D、1:12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标况下,11.2L SO3所含的分子数目为0.5 NA |
| B、室温下,1L pH=1的稀硫酸溶液中,由水电离的H+离子数目为0.2NA |
| C、铅蓄电池放电时,正极消耗4mol H+,则电路中通过的电子数目为2NA |
| D、8 Al+3 NH4ClO4═4 Al2O3+3NH3+3HCl 反应中,消耗27gAl粉时,转移的电子数目为2.75NA(Al原子量-27) |
查看答案和解析>>
科目:高中化学 来源: 题型:
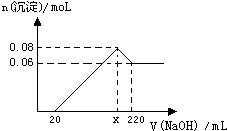 现有MgO和Al2O3的固体混合物,向其中加入100mL 2moL?L-1稀盐酸,充分反应后向溶液中逐滴加入 1moL?L-1的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液体积之间的关系如图:
现有MgO和Al2O3的固体混合物,向其中加入100mL 2moL?L-1稀盐酸,充分反应后向溶液中逐滴加入 1moL?L-1的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液体积之间的关系如图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com