
| A. | 金刚石 | B. | 硬铝 | C. | 不锈钢 | D. | 青铜 |
 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:实验题
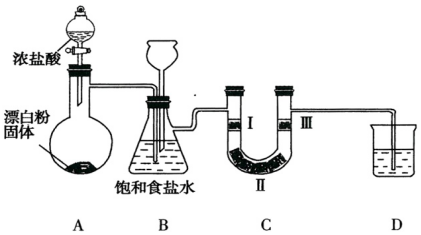
| 编号 | I | II | III |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
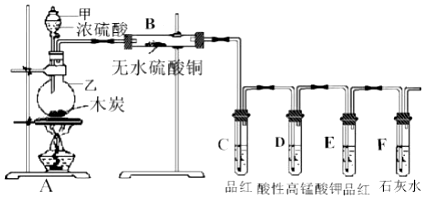
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
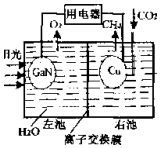 太阳能光电池由于具有可靠性好、寿命长等特点,适于很多特蛛环境和场合,现已得到广泛应用.氮化镓(GaN)光电池的结构如图所示.下列说法中正确的是( )
太阳能光电池由于具有可靠性好、寿命长等特点,适于很多特蛛环境和场合,现已得到广泛应用.氮化镓(GaN)光电池的结构如图所示.下列说法中正确的是( )| A. | 该装置系统中只存在两种能量转化 | |
| B. | Cu电极上的电极反应为:CO2+8e-+8H+═CH4+2H2O | |
| C. | 离子交换膜为质子交换膜,H+从右池移向左池 | |
| D. | 常温下,当装置中有1mol CH4生成时,GaN电极有 44.8LO2生成(不考虑O2的溶解性) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L甲醇中含有的分子数为0.5NA | |
| B. | 4.4gN2O和CO2的混合气体中含有的原子数为0.3NA | |
| C. | 4.2g乙烯和丙烯混合气体中含有的共价键数为0.6NA | |
| D. | 25°C时,1.0L,PH=13 的 Ba(OH)2 溶液中含有的OH-数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 C、N、O、Na、Al、Si、S、Cl是常见的八种元素
C、N、O、Na、Al、Si、S、Cl是常见的八种元素 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com