
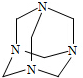
 乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示.将甲醛水溶液与氨水混合蒸发可制得乌洛托品.若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为( )
乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示.将甲醛水溶液与氨水混合蒸发可制得乌洛托品.若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为( )| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 2:1 |
分析 将甲醛水溶液与氨水混合蒸发可制得乌洛托品,若原料完全反应生成乌洛托品,每个乌洛托品分子中含有6个C原子、4个N原子,根据C原子、N原子守恒判断甲醛和氨的物质的量之比.
解答 解:将甲醛水溶液与氨水混合蒸发可制得乌洛托品,若原料完全反应生成乌洛托品,每个乌洛托品分子中含有6个C原子、4个N原子,每个甲醛分子中含有1个C原子、每个氨气分子中含有1个N原子,根据C原子、N原子守恒知,要形成一个乌洛托品分子需要6个甲醛分子、4个氨气分子,则需要甲醛和氨气分子个数之比=6:4=3:2,根据N=nNA知,分子数之比等于物质的量之比,所以甲醛与氨的物质的量之比3:2,
故选C.
点评 本题考查物质的量的有关计算,为高频考点,明确物质的量的基本公式及物质的构成是解本题关键,注意结合原子守恒解答,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在酸性重铬酸钾溶液中加入少量乙醇:3COH3CH2OH+2Cr2O72-+13H+→4Cr3++3CH3COO-+11H2O | |
| B. | AlCl3•6H2O与SOCl2混合并加热:AlCl3•6H2O+3SOCl2$\frac{\underline{\;\;△\;\;}}{\;}$Al(OH)3+3SO2↑+9HCl | |
| C. | SbCl3水解:SbCl3+H2O?SbOCl+2HCl | |
| D. | 在碘的四氯化碳溶液中加浓的KI溶液:I2+3I-?I3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C14H18O5 | B. | C14H16O4 | C. | C16H22O5 | D. | C16H20O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和SiO2 | B. | CO2 和NaCl | C. | NH4Cl 和HCl | D. | H2O2和C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
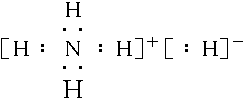 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
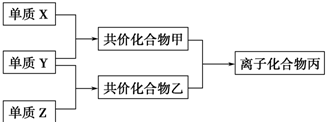
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com