
分析 (1)将1molNH4Cl和0.2molNaOH溶于水配成1L溶液,溶液中的溶质是NH4Cl、NH3•H2O、NaCl,NH3.H2O和H2O都是弱电解质,部分电离,溶液中存在的微粒有:Na+、Cl-、NH3•H2O、NH4+、OH-、H2O、H+,结合物料书恒解答该题;
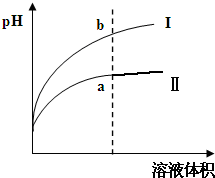
(2)盐酸是强电解质,醋酸是弱电解质,相同pH值的盐酸和醋酸溶液分别加水稀释,醋酸稀释促进醋酸电离继续产生氢离子,故稀释相同的倍数,醋酸的pH增大的较小.
(3)Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液.
①pH=13的Ba(OH)2溶液中氢离子使由水电离产生的,水电离产生的c(H+)等于溶液中由水电离出c(OH -);
②pH=13的Ba(OH)2溶液中c(OH-)=0.1mol/L,与某浓度盐酸溶液按体积比(碱与酸之比)1:9混合后,假定体积分别为1L、9L,所得溶液pH=11,即混合后溶液中c(OH -)=10-3mol/L,令盐酸的浓度为amol/L,用a表示出混合后溶液中n(OH -),列方程计算
解答 解:(1)①液中的溶质是NH4Cl、NH3•H2O、NaCl,NH4Cl是强酸弱碱盐能发生水解,所以存在平衡 体系; NH3.H2O和H2O都是弱电解质,部分电离,所以存在平衡体系,离子方程式为NH3•H2O?NH3+H2O、NH3•H2O?NH4++OH-、NH4++H2O?NH3•H2O+H+、H2O?H++OH-,
故答案为:NH3•H2O?NH3+H2O;NH3•H2O?NH4++OH-;NH4++H2O?NH3•H2O+H+;
②1molNH4Cl配成1L溶液,Cl-浓度为1mol/L,故答案为:Cl-;
③无论NH4+水解程度和NH3.H2O的电离的程度如何,但遵守物料守恒,即NH4+、NH3•H2O、NH3的物质的量之和为1mol,
故答案为:NH4+、NH3•H2O、NH3.
(2)盐酸是强电解质,醋酸是弱电解质,相同pH值的盐酸和醋酸溶液分别加水稀释,醋酸稀释促进醋酸电离继续产生氢离子,故稀释相同的倍数,醋酸的PH增大的较小,故图Ⅱ为醋酸稀释的图象,
故答案为:Ⅱ.
(3)①pH=13的Ba(OH)2溶液中氢离子使由水电离产生的,水电离产生的c(H+)等于溶液中水电离出c(OH -),故水电离出c(OH -)=c(H+)=10-13mol/L,
故答案为:10-13mol/L;
②pH=13的Ba(OH)2溶液中c(OH-)=0.1mol/L,与某浓度盐酸溶液按体积比(碱与酸之比)1:9混合后,假定体积分别为1L、9L,所得溶液pH=11,即混合后溶液中c(OH-)=10-3mol/L,令盐酸的浓度为amol/L,则混合后溶液中n(OH-)=1L×0.1mol/L-9L×amol/L=10-3mol/L×(1L+9L),解得a=0.01,所以pH=2
故答案为:2.
点评 本题考查电解质、溶液PH的有关计算、盐类水解与离子浓度的大小比较、弱电解质的电离等,综合性较大,难度中等,是对知识的综合运用,需要学生具有扎实的基础知识


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 实验操作 | 实验目的 |
| A | 测定HF、HCl熔点、沸点 | 比较F和Cl的非金属性强弱 |
| B | MgSO4、Al2(SO4)3溶液中分别滴加足量氨水 | 比较镁、铝的金属性强弱 |
| C | 测定等浓度的H2CO3、H2SO3两溶液的pH | 比较碳、硫的非金属性强弱 |
| D | 向氯化铵、氯化铝混合溶液中滴加氢氧化钠溶液至过量 | 比较氨水和氢氧化铝的碱性强弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应属于加成反应 | |
| B. | 水杨醛能被酸性高锰酸钾溶液氧化为水杨酸 | |
| C. | 可用新制的Cu(OH)2悬浊液区别水扬醛和香豆素 | |
| D. | 水杨醛、乙酸肝和香豆素都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若a≤b,则混合溶液的pH大于7 | |
| B. | 若a=2b,溶液呈酸性,则[CH3COO-]>[Na+]>[CH3COOH]>[H+]>[OH-] | |
| C. | 混合溶液中[Na+]+[H+]=[OH-]+[CH3COO-]一定成立 | |
| D. | 混合溶液中[CH3COO-]+[CH3COOH]=a mol/L 一定成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
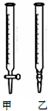 用0.1032mol•L-1 HCl溶液滴定未知浓度的NaOH溶液,
用0.1032mol•L-1 HCl溶液滴定未知浓度的NaOH溶液,| 滴定次数 | 待测溶液的体积(/mL) | 标准HCl溶液的体积 | |
| 滴定前读数(/mL) | 滴定后读数(/mL) | ||
| 1 | 25.00 | 1.02 | 21.04 |
| 2 | 25.00 | 2.00 | 22.98 |
| 3 | 25.00 | 0.20 | 20.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为50% | |
| B. | 反应可表示为X(g)+3Y(g)?2Z(g),其平衡常数为1600 (L/mol)2 | |
| C. | 增大压强,平衡常数增大 | |
| D. | 改变温度可以改变此反应的平衡常数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com