
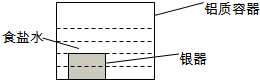
 银制器皿表面日久因生成Ag2S而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去.有关说法正确的是( )
银制器皿表面日久因生成Ag2S而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去.有关说法正确的是( )

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:013
下列叙述中正确的是
[ ]
①锌跟稀硫酸制取氢气,加入少量硫酸铜溶液能加快反应速率 ②镀层破坏后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀 ③钢铁表面常易锈蚀生成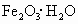
查看答案和解析>>
科目:高中化学 来源: 题型:013
下列叙述中正确的是
[ ]
①锌跟稀硫酸制取氢气,加入少量硫酸铜溶液能加快反应速率 ②镀层破坏后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀 ③钢铁表面常易锈蚀生成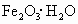
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市普陀区高三上学期质量调研化学试卷(解析版) 题型:选择题
银制器皿表面日久因生成Ag2S而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去。有关说法正确的是
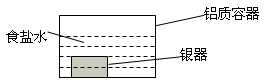
A.该处理过程中电能转化为化学能
B.银器为正极,Ag2S还原为单质银
C.Ag2S溶解于食盐水生成了AgCl
D.铝质容器为阳极,其质量变轻
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com