(1)在岩洞、钟乳石的形成过程中包含下列反应:
CaCO3(s)+H2O(l)+CO2(g)?Ca2+(aq)+2HCO3-(aq)△H=-321.7kJ/mol
①写出该反应的平衡常数表达式:K=______
②Ca(HCO3)2 溶液中的 c(OH-) 与c(H+)、c(H2CO3)、c(CO32-)之间的关系为:c(OH-)=______
(2)美丽的珊瑚和珍珠的主要成分都是碳酸钙,而便宜的“珊瑚礁”是用石膏制成的,请设计一个简单的实验方案区分真假珊瑚礁:______.
(3)锅炉水垢中含有的CaSO4,可先用碳酸钠溶液处理,使之转化为疏松、易溶于酸的物质,该转化的离子方程式是______.
【答案】
分析:(1)①化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,注意虽然水为液态,在该情况下应,应写出;
②溶液中存在H
2O?H
++OH
-,HCO
3-?H
++CO
32-,HCO
3-+H
2O?OH
-+HCO
3-,溶液氢氧根来源于水的电离,与碳酸氢根的水解,水电离的氢氧根浓度为c(H
+)-c(CO
32-),碳酸氢根水解得到氢氧根浓度等于碳酸的浓度,据此进行解答;
(2)通过检验是否含有碳酸根,进行鉴别;
(3)水垢中含有的CaSO
4,先用碳酸钠溶液处理,转化为 CaCO
3.
解答:解:(1)①CaCO
3(s)+H
2O(l)+CO
2(g)?Ca
2+(aq)+2HCO
3-(aq)平衡常数k=
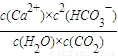
,
故答案为:

;
②溶液中存在H
2O?H
++OH
-,HCO
3-?H
++CO
32-,HCO
3-+H
2O?OH
-+HCO
3-,溶液氢氧根来源于水的电离,与碳酸氢根的水解,水电离的氢氧根浓度为c(H
+)-c(CO
32-),碳酸氢根水解得到氢氧根浓度等于碳酸的浓度,故溶液中c(OH
-)=c(H
+)+c(H
2CO
3)-c(CO
32-),
故答案为:c(OH
-)=c(H
+)+c(H
2CO
3)-c(CO
32-);
(2)通过检验是否含有碳酸根,进行鉴别,具体操作:取少量待检珊瑚礁于试管中,加入足量稀盐酸,若放出大量能使澄清石灰水变浑浊的无色气体,珊瑚礁为真,否则为假,
故答案为:取少量待检珊瑚礁于试管中,加入足量稀盐酸,若放出大量能使澄清石灰水变浑浊的无色气体,珊瑚礁为真,否则为假;
(3)水垢中含有的CaSO
4,先用碳酸钠溶液处理,转化为 CaCO
3,转化的离子方程式是CaSO
4(s)+CO
32- (aq)?CaCO
3(s )+SO
42- (aq),
故答案为:CaSO
4(s)+CO
32- (aq)?CaCO
3(s )+SO
42- (aq).
点评:本题考查化学平衡常数、离子浓度的比较、实验方案设计、沉淀转化等,(1)为易错点、难点,学生容易忽略水,难度中等.

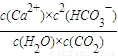 ,
, ;
;

 阅读快车系列答案
阅读快车系列答案