
分析 (1)根据铬的核外电子排布规律可知,铬在最外层是N层,有2个电子,据此答题;
(2)根据反应Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Cr+Al2O3是放热,利用反应热△H=反应物的总键能-生成物的总键能来解答;分子晶体中分子间存在范德华力;
(3)两原子形成共价键时,有且仅有一个为σ键,其它为π键,丙烯分子中碳原子周围有三个σ键,没有孤电子对,据此判断;
(4)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点,以晶胞顶点的Pr原子为例,与之距离最近的氧原子位于立方体的体对角线上,每个顶点为8故晶胞共用,根据均摊法计算晶胞中Pr原子数目,再根据化学式中原子数目之比计算晶胞中O原子数目;
(5)根据均摊法计算,再根据密度ρ=$\frac{m}{V}$计算;
解答 解:(1)铬的核外电子排布式为1s22s22p63s23p63d54s1,所以铬在最外层是N层,有1个电子,N层上原子轨道为spdf四种,共有轨道数为1+3+5+7=16,价电子排布式为3d54s1,
故答案为:N;16;3d54s1;
(2)反应Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Cr+Al2O3是放热,△H<O,由反应热△H=反应物的总键能-生成物的总键能可知Cr-O键的键能小于Al-O键,Al-O稳定性更强,分子晶体中分子间存在范德华力,所以固态氯化铝晶体类型是分子晶体;
故答案为:Al-O;分子晶体;
(3)两原子形成共价键时,有且仅有一个为σ键,其它为π键,根据V2O5的结构式可知,V2O5分子含 6个σ键和4个π键,丙烯分子中连有双键的碳原子周围有三个σ键,没有孤电子对,甲基中的碳有4个σ键,所以丙烯分子中碳原子的杂化方式为sp2、sp3,
故答案为:6;4;sp2、sp3;
(4)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点,晶胞中Pr原子数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,而Pr原子与O原子数目之比为1:2,则晶胞中O原子数目为4×2=8,以晶胞顶点的Pr原子为例,与之距离最近的氧原子位于立方体的体对角线上,每个顶点为8故晶胞共用,Pr的配位数为8,
故答案为:8;8;
(5)①每个Fe2+周围最近的等距离的S22-离子存在于面心,共有6个,故答案为:6;
②一个晶胞内含有Fe2+数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,含有S2-数目为12×$\frac{1}{4}$+1=4,一个晶胞的质量m=$\frac{120g/mol×4}{{N}_{A}}$,一个晶胞体积V=a03,则晶胞密度ρ=$\frac{m}{V}$=$\frac{120g/mol×4}{(0.54×1{0}^{-7}cm)^{3}×6.02×1{0}^{23}}$=5.06g•cm-3,
故答案为:5.06.
点评 本题考查较为综合,涉及核外电子排布、原子结构、化学键、晶体类型、晶胞的结构及晶体计算等知识,题目难度中等,侧重考查对基础知识的应用,需要学生具备扎实的基础,难度中等.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | S | SCl2 | S2Cl2 |
| 沸点/℃ | 445 | 59 | 137 |
| 熔点/℃ | 113 | -122 | -77 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径C>D>E,三者形成的简单离子中D离子的半径最小 | |
| B. | 元素A所形成的氢化物常温下一定为气态 | |
| C. | 元素C、D、E在自然界中均不能以游离态存在 | |
| D. | 元素B的氧化物对应的水化物一定为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Mn(OH)2/Mn(OH)3 |
| 开始沉淀pH | 2.7 | 7.6 | 5.7 | 8.3 |
| 完全沉淀pH (c≤1.0×10-5mol/L) | 3.7 | 9.6 | 8.0 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
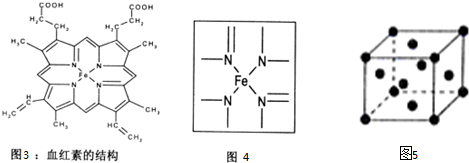
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
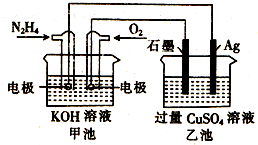
| A. | 该装置工作时,Ag电极上有气体生成 | |
| B. | 甲池中负极反应为N2H4-4e-=N2+4H+ | |
| C. | 甲池和乙池中的溶液的pH均减小 | |
| D. | 当甲池中消耗0.1mol N2H4时,乙池中理论上最多产生6.4g固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
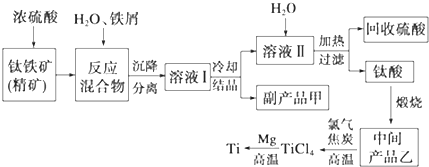
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com