
| A. | NH3属于离子化合物 | |
| B. | 常温下,液氨的电离平衡常数为10-14 | |
| C. | 液态氨与氨水的组成相同 | |
| D. | 液氨中的微粒含相同的电子数 |
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:解答题
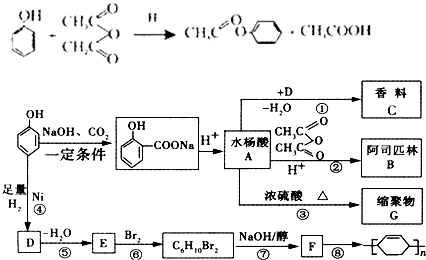
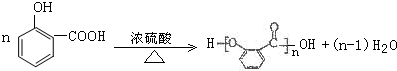 .
.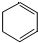 ;
;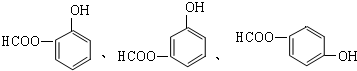 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
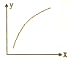 MgO可以通过下列反应制备:MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g)△H>0,该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
MgO可以通过下列反应制备:MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g)△H>0,该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( ) | 选项 | x | y |
| A | CO的物质的量 | CO与CO的物质的量之比 |
| B | SO的浓度 | 平衡常数K |
| C | 温度 | 容器内混合气体的密度 |
| D | CO的浓度 | CO的转化率 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
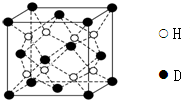 已知A、B、C、D、E、F、G、H、I为元素周期表中原子序数依次增大的前四周期元素,A原子的最外层中p轨道上的电子数等于前一电子层电子总数;A、B、C、D;E、F与G分别位于同一周期.C原子L层上有2对成电子,D、E、F的核外电子排布相同的简单离子可形成一种E3FD6型离子晶体X,EG、HC为电子数相同的离子晶体.I原子M层为全充满状态,且核外的未成对电子只有一个.请根据以上情况,回答下列问题:(答题时,用对应的元素符号表示)
已知A、B、C、D、E、F、G、H、I为元素周期表中原子序数依次增大的前四周期元素,A原子的最外层中p轨道上的电子数等于前一电子层电子总数;A、B、C、D;E、F与G分别位于同一周期.C原子L层上有2对成电子,D、E、F的核外电子排布相同的简单离子可形成一种E3FD6型离子晶体X,EG、HC为电子数相同的离子晶体.I原子M层为全充满状态,且核外的未成对电子只有一个.请根据以上情况,回答下列问题:(答题时,用对应的元素符号表示)查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作 | 现 象 | 结 论 |
| A | 在试管中滴入适量C2H5X与NaOH溶液,振荡、加热、静置分层后,取水层加稀硝酸酸化,再滴加数滴AgNO3溶液 | 淡黄色沉淀 | 证明卤代烃中含有溴元素 |
| B | 将蘸有浓氨水的玻璃棒置于某无机酸浓溶液的试剂瓶口 | 有大量白烟 | 该无机酸一定为盐酸 |
| C | 在大试管中依次加入适量丁醇、过量乙酸、几滴浓硫酸,混合后塞上带长导管的试管塞,放在石棉网上方空气中加热至120℃左右 | 反应液沸腾,冷却静置,上层油状透明液体有水果香味 | 该油状液体为乙酸丁酯 |
| D | 在简易启普发生器中向石灰石中加入浓醋酸,将产生的气体直接通入苯酚钠溶液中 | 苯酚钠溶液产生浑浊 | 酸性:醋酸>碳酸>苯酚 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 | |
| B. | 向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小 | |
| C. | 向0.0008mol/L的K2CrO4溶液中加入等体积的0.002mol/LAgNO3溶液,则CrO42-完全沉淀 | |
| D. | 将0.001mol/L的AgNO3溶液滴入0.001mol/L的KCl和0.001mol/L的K2CrO4溶液,则先产生AgCl沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 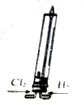 该装置可模拟工业制取氯化氢 | |
| B. | 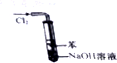 如图实验装置可以处理Cl2尾气,并防止倒吸 | |
| C. |  如图实验制取少量的Fe(OH)3胶体 | |
| D. | 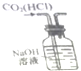 如图实验装置可除去CO2气体中含有的少量HCl杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 .
.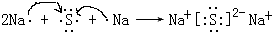 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com