
| A. | 分子晶体中的每个分子内一定含有共价键 | |
| B. | 离子晶体中可能含有共价键 | |
| C. | 原子晶体中的相邻原子间只存在非极性共价键 | |
| D. | 金属晶体的熔点和沸点都很高 |
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
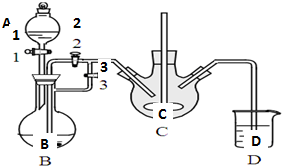 乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:
乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2 | B. | CO2和O2 | C. | NO2和O2 | D. | NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铍与铝原子核外具有相同的未成对电子数 | |
| B. | 氢氧化铍能与强酸、强碱溶液反应 | |
| C. | 铍与铝元素具有相同的最高正化合价 | |
| D. | 氧化铍只溶于强酸溶液,不溶于强碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3,3-二甲基-4-乙基戊烷 | B. | 3,3,4-三甲基己烷 | ||
| C. | 3,4,4-三甲基己烷 | D. | 2,3-三甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一种元素可能有多种氧化物,但是同种化合价只对应一种氧化物 | |
| B. | 阳离子只能得到电子被还原,只能做氧化剂 | |
| C. | 含有最高价元素的化合物不一定有强的氧化性 | |
| D. | 氧化物不可能是还原产物,只可能是氧化产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com