
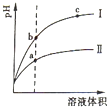
 某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断正确的是( )
某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断正确的是( )| A、Ⅱ为盐酸稀释时pH变化曲线 |
| B、导电性:b点>c点 |
| C、Kw的数值:a点>c点 |
| D、酸的总浓度:b点>a点 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
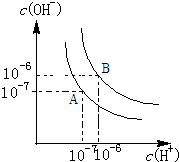 水的电离平衡如图所示.
水的电离平衡如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中导电粒子的数目增加,导电性增强 | ||
| B、醋酸的电离程度增大,c(H+)亦增大 | ||
| C、再加入10mLpH=11NaOH溶液,混合液pH=7 | ||
D、溶液中
|
查看答案和解析>>
科目:高中化学 来源: 题型:
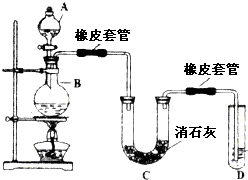 瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(该反应是放热反应),据此回答下列问题:
瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(该反应是放热反应),据此回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、少量金属钠加到冷水中:Na+H2O=Na++OH-+H2↑ |
| B、铁与稀盐酸反应:2Fe+6H+=2 Fe3++3H2↑ |
| C、氯气通入冷的氢氧化钠溶液中:Cl2+2OH-=Cl-+ClO-+H2O |
| D、过量的二氧化碳通入氢氧化钠溶液:CO2+2OH-=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、甘氨酸(α-氨基乙酸)与氢氧化钠溶液反应: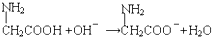 | ||
| B、高级脂肪酸与氢氧化钠溶液反应:H++OH-=H2O | ||
| C、苯酚钠溶液中通入少量CO2:2C6H5O-+H2O+CO2→2C6H5OH+CO32- | ||
D、乙醛与银氨溶液的反应:CH3CHO+2[Ag(NH3)2]++2OH-
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com