
| A. | 44g CO2和N2O的混合物中含有的氧原子数为1.5NA | |
| B. | 2L 0.5mol/L亚硫酸氢钠溶液中含有的HSO3-离子数为NA | |
| C. | 0.5mol CH5+中含有的电子数目为5NA | |
| D. | 常温下,1L 0.5 mol/L Ba(OH)2溶液中水电离的OH-个数为0.1NA |
分析 A、二氧化碳和N2O的摩尔质量相同,但含有的氧原子的个数不同;
B、HSO3-离子在溶液中既能电离又能水解;
C、CH5+中含10个电子;
D、在氢氧化钡溶液中,氢氧根绝大多数来自于氢氧化钡的电离,水的电离被抑制.
解答 解:A、二氧化碳和N2O的摩尔质量相同,均为44g/mol,故44g混合物的物质的量为1mol,但两者含有的氧原子的个数不同,且比例未知,故1mol混合物中含有的氧原子的个数无法计算,故A错误;
B、HSO3-离子在溶液中既能电离又能水解,故此溶液中含有的HSO3-离子数小于NA,故B错误;
C、CH5+中含10个电子,故0.5molCH5+中含有的电子为5mol,数目为5NA,故C正确;
D、常温下,1L 0.5 mol/L Ba(OH)2溶液中氢氧根的浓度为1mol/L,c(H+)=10-14mol/L.而在氢氧化钡溶液中,氢氧根绝大多数来自于氢氧化钡的电离,氢离子全部来自于水的电离,且水电离出的氢氧根的浓度等于氢离子浓度,故此溶液中水电离出的氢氧根浓度为10-14mol/L,物质的量为10-14mol,个数为10-14NA,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意公式的运用和物质的结构特点.


科目:高中化学 来源: 题型:选择题
| A. | 2NH3+H2SO4(浓)═(NH4)2SO4 | |
| B. | C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+2SO2↑+2H2O | |
| C. | Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O | |
| D. | 2FeO+4H2SO4(浓)═Fe2(SO4)3+SO2↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅晶体是一种重要的半导体材料,在常温下,单质硅易与氧气反应,所以自然界中不存在游离态的硅.石墨烯作为目前发现的最薄、强度最大、导电导热性能最强的一种新型纳米材料,最有潜力的应用是成为硅的替代品用来生产未来的超级计算机 | |
| B. | 电解水制氢比光催化还原水制氢更节能环保、更经济 | |
| C. | 为迎接G20峰会,全温州市努力植树造林,节能减排防治PM2.5,PM2.5是指大气中直径小于或等于2.5纳米的可吸入颗粒物 | |
| D. | 某些铝硅酸盐形成的分子筛中有许多笼状空穴和通道,常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
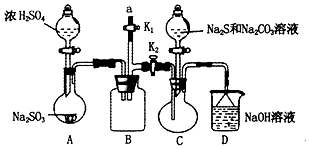 硫代硫酸钠(Na2S2O3)是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性条件下易分解,在空气中易被氧化.某化学兴趣小组通过如图装置(省略夹持装置)制备Na2S2O3.
硫代硫酸钠(Na2S2O3)是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性条件下易分解,在空气中易被氧化.某化学兴趣小组通过如图装置(省略夹持装置)制备Na2S2O3.| 实验序号 | 溶液pH | 亚硫酸钠与水的质量比 | 反应温度 | 硫粉质量 | 亚硫酸钠转化率 |
| 1 | 10 | 1.5:1 | 100℃ | 18 | 80.7% |
| 2 | 10 | 1.1:1 | 100℃ | 18 | 94.6% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
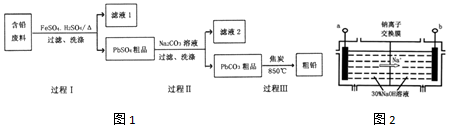
| 编号 | 实验操作 | 现象 |
| 步骤1 | 向酸化的FeSO4溶液中加入KSCN溶液 | 溶液几乎无色 |
| 步骤2 | 取步骤1中反应液少量,加入少量PbO2,充分反应 | 溶液变红 |
| 步骤3 | 取步骤2中反应液少量,加入足量Pb,充分反应 | 红色褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 《电石安全技术说明书》中对电石的描述为“…遇水或湿气能迅速产生高度易燃的乙炔气体,应与氧化剂类物质分开存放…”.下列说法不合理的是( )
《电石安全技术说明书》中对电石的描述为“…遇水或湿气能迅速产生高度易燃的乙炔气体,应与氧化剂类物质分开存放…”.下列说法不合理的是( )| A. | 盛装电石的包装上贴有的危险化学品标志为: | |
| B. | 电石与硝酸分开存放 | |
| C. | 运输电石的铁桶内可充入氮气 | |
| D. | 电石着火可用泡沫灭火器扑灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使pH试纸变深蓝色的溶液:Na+、AlO2-、S2-、CO32- | |
| B. | Na2S溶液中:K+、Na+、NO3-、Ag+ | |
| C. | 含有大量Al3+的水溶液中:Na+、NH4+、HCO3-、Br- | |
| D. | 水电离产生的H+浓度为1×10-12mol•L-1的溶液:NH4+、Na+、Cl-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com