
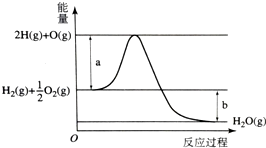
 已知H2O(g)=H2(g)+$\frac{1}{2}$O2(g),反应过程中能量变化如图所示.请回答下列问题:
已知H2O(g)=H2(g)+$\frac{1}{2}$O2(g),反应过程中能量变化如图所示.请回答下列问题: 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| 离子半径 | 酸性 | 还原性 | 得电子能力 |
| N3-> Al3+ | H2SO4< HClO4 | O2-< S2- | 35Cl= 37Cl |
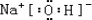 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
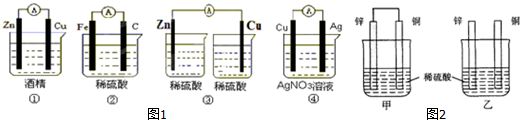
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液的导电性比盐酸弱 | |
| B. | 0.1mol/LCH3COOH溶液中,氢离子浓度约为0.001mol/L | |
| C. | 醋酸溶液用水稀释后,氢离子浓度下降 | |
| D. | 醋酸溶液与碳酸钙反应,缓慢放出二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(B2)=0.8mol/(L•s) | B. | V(A2)=0.8mol/(L•s) | ||
| C. | V(C)=0.6mol/(L•s) | D. | V(A2)=1.8mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
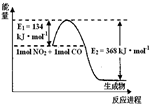 通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(△H).
通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(△H).| 化学键 | Cl-Cl | H-H | H-Cl | N≡N |
| 键能/kJ•mol | 243 | 436 | 431 | 946 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取8.0gCuSO4,加入500mL水 | |
| B. | 称取7.68gCuSO4,加入480mL水 | |
| C. | 称取12.5gCuSO4•5H2O,加水配成500mL溶液 | |
| D. | 称取12.0gCuSO4•5H2O,加水配成480mL溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com