
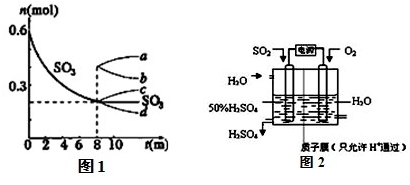
| T/℃ | T2 | T3 |
| K | 20.5 | 4.68 |
| 消耗量 |
| 起始量 |
| c(SO 3) 2 |
| c(SO 2) 2c(O 2) |
| 0.4 |
| 0.6 |
| c(SO 3) 2 |
| c(SO 2) 2c(O 2) |
| 0.2 2 |
| 0.4 2×0.2 |
| 0.2 2 |
| 0.22×x |


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
| A、标准状况下,11.2L SO3中所含有的原子数2NA |
| B、实验室中用4mol HCl的浓盐酸跟足量MnO2 加热反应可制得的Cl2分子数为NA |
| C、25℃时,pH=13的1.0L Ba(OH)2溶液中含有OH-的数目为0.2NA |
| D、2.3g钠与一定量的氧气完全反应,转移的电子数一定为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
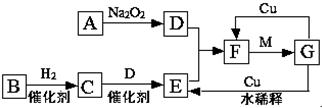 如图是由短周期元素组成的一些单质及其化合物之间的转化关系图.各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无刺激性气味的气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体.
如图是由短周期元素组成的一些单质及其化合物之间的转化关系图.各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无刺激性气味的气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体.查看答案和解析>>
科目:高中化学 来源: 题型:
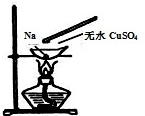 如图,在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成.据此判断下列说法中不正确的是( )
如图,在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成.据此判断下列说法中不正确的是( )| A、上述反应是置换反应 |
| B、上述反应说明钠比铜活泼 |
| C、上述反应证明钠可以从CuSO4溶液中置换出铜 |
| D、加热且无水条件下,Na可以与CuSO4反应并生成Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
 高锰酸钾是实验中常见的氧化剂.KMnO4溶液在中性或碱性条件下分解速度较慢,酸性条件下水溶液稳定性较差,有二氧化锰和氧气析出,见光分解速率加快.
高锰酸钾是实验中常见的氧化剂.KMnO4溶液在中性或碱性条件下分解速度较慢,酸性条件下水溶液稳定性较差,有二氧化锰和氧气析出,见光分解速率加快.| 实验序号 | KMnO4 溶液体积/mL |
| I | 20.02 |
| II | 19.98 |
| III | 22.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2+OH-→HCO3- |
| B、AlO2-+CO2+2H2O→Al(OH)3↓+HCO3- |
| C、2AlO2-+CO2+3H2O↓→2Al(OH)3↓+CO32- |
| D、CO32-+CO2+2H2O→2HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2+、SO42-、K+、Cl- |
| B、Na+、NH4+、NO3-、MnO4- |
| C、K+、Cu2+、Cl-、Br- |
| D、Ba2+、Na+、OH-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com