
| A | B | C | D | E | F | |
| 主要化合价 | -1 | -3+5 | -2+6 | -1+7 | +2 | +1+2 |
| 原子半径nm | 0.071 | 0.11 | 0.102 | 0.099 | 0.197 | 0.117 |
分析 原子序数依次增加的A、B、C、D、E、F六种常见元素中,A、B、C、D是短周期非金属元素,B、C、D同周期,E、F是第四周期的金属元素,F+的三个能层电子全充满,则F原子核外电子数=2+8+18+1=29,为Cu元素,F为金属元素,且原子序数大于E,则E是Ca元素;
根据元素化合价知,A、D所以第VIIA族元素,D有正化合价则A是F元素、D是Cl元素;
B元素属于第VA族元素,原子半径大于D,则B属于P元素;
C元素属于第VIA族元素,有正化合价,则C为S元素;
再结合题目分析解答.
解答 解:原子序数依次增加的A、B、C、D、E、F六种常见元素中,A、B、C、D是短周期非金属元素,B、C、D同周期,E、F是第四周期的金属元素,F+的三个能层电子全充满,则F原子核外电子数=2+8+18+1=29,为Cu元素,F为金属元素,且原子序数大于E,则E是Ca元素;根据元素化合价知,A、D所以第VIIA族元素,D有正化合价则A是F元素、D是Cl元素;B元素属于第VA族元素,原子半径大于D,则B属于P元素;
C元素属于第VIA族元素,有正化合价,则C为S元素;则A、B、C、D、E、F六种元素分别是F、P、S、Cl、Ca、Cu元素,
(1)B、C、D分别是P、S、Cl元素,同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第VA族元素第一电离能大于其相邻元素,所以这三种元素第一电离能从小到大顺序是S<P<Cl,
故答案为:S<P<Cl;
(2)B的氢化物是PH3,该分子结构和氨气分子结构相似,所以P原子采用sp3杂化,为三角锥形结构,该分子中正负电荷重心不重合,为极性分子,
故答案为:sp3;三角锥;极性;
(3)铜氨络离子中配体个数是4,所以其配离子化学式为[Cu(NH3)4]2+,铜晶胞为面心立方晶胞,故选③,
故答案为:[Cu(NH3)4]2+;③;
(4)A、E两种元素形成化合物CaF2,钙离子和氟离子个数之比为1:2,则符合条件的基本为②,该晶胞中F离子的配位数是4;把该晶胞分成8个小立方体,如: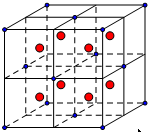 最近的两个F、Ca离子之间的距离为小立方体的对角线的一半,则其距离为:$\frac{\sqrt{(\frac{a}{2})^{2}+(\frac{a}{2})^{2}+(\frac{a}{2})^{2}}}{2}$pm=$\frac{\sqrt{3}}{4}$apm,
最近的两个F、Ca离子之间的距离为小立方体的对角线的一半,则其距离为:$\frac{\sqrt{(\frac{a}{2})^{2}+(\frac{a}{2})^{2}+(\frac{a}{2})^{2}}}{2}$pm=$\frac{\sqrt{3}}{4}$apm,
故答案为:②;4;$\frac{\sqrt{3}}{4}$a;
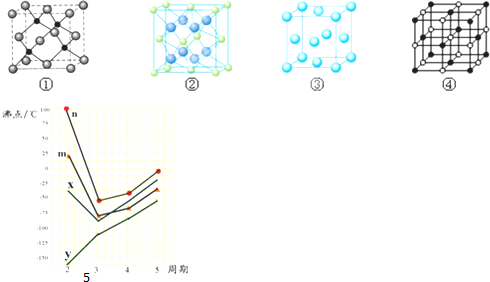
(5)C是S元素,处于ⅥA族,在ⅣA族、ⅤA族、ⅥA族、ⅦA族元素,第二周期元素形成的氢化物中,H2O通常为液体,沸点最高,故折线n表示第ⅥA族元素氢化物的沸点变化,故H2S所在的折线为n,
故答案为:n.
点评 本题考查位置、结构与性质关系的综合应用,题目难度中等,试题知识点较多、综合性较强,要求学生能够根据价层电子对互斥理论确定分子空间构型、原子杂化方式,明确氢键对物质性质的影响,难点是晶胞的计算.


科目:高中化学 来源: 题型:选择题
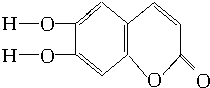 (C、H原子未画出,每个折点表示一个C原子),具有抗菌作用.若1mol的七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗溴水和NaOH的物质的量分别为( )
(C、H原子未画出,每个折点表示一个C原子),具有抗菌作用.若1mol的七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗溴水和NaOH的物质的量分别为( )| A. | 3 mol Br2、2 mol NaOH | B. | 3 mol Br2、4 mol NaOH | ||
| C. | 2 mol Br2、3 mol NaOH | D. | 4 mol Br2、4 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
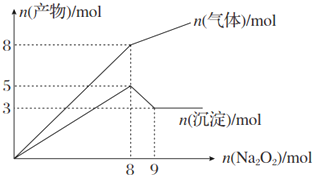
| A. | 2 mol、3 mol、4 mol | B. | 2 mol、3 mol、8 mol | ||
| C. | 3 mol、2 mol、8 mol | D. | 3 mol、2 mol、4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
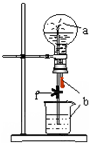 如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是
如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是 | a(干燥气体) | b(液体) | |
| A | NO2 | 水 |
| B | CO2 | 饱和NaHCO3溶液 |
| C | Cl2 | 饱和NaCl水溶液 |
| D | NH3 | NaNO3稀溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.18g | B. | 2.12g | C. | 4.22g | D. | 5.28g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取7.6g硫酸铜,加入500 mL的水 | B. | 称取8.0g硫酸铜,配成500mL溶液 | ||
| C. | 称取12.0g胆矾,配成500mL溶液 | D. | 称取12.5g胆矾,加入500mL水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合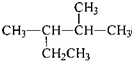 的名称为2-甲基-3-乙基丁烷 的名称为2-甲基-3-乙基丁烷 | |
| B. | 甲醇、乙醇、甘油互为同系物 | |
| C. | 等物质的量的乙炔、乙醛,完全燃烧时的耗氧量不相等 | |
| D. | 以乙烯为原料制备乙酸乙酯的合成路线可以为: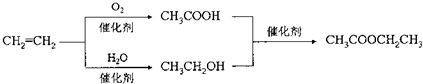 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com