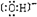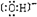有位于周期表前四周期的A、B、C、D、E、F六种元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素.已知A、C及B、E分别是同主族元素,且B、E两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍.处于同周期的C、D、E三种元素中,D是该周期金属元素中金属性最弱的元素.F元素形成的氧化物有多种,其中之一为红棕色粉末W.
(1)化合物X是由A、B、C形成的,其晶体类型为
离子晶体
离子晶体
,其阴离子的电子式为
;
(2)写出W物质的一种用途
炼铁原料或油漆的原料等
炼铁原料或油漆的原料等
;
(3)写出两种均含A、B、C、E四种元素的化合物在溶液中相互反应、且生成气体的化学方程式
NaHSO4+NaHSO3═Na2SO4+SO2↑+H2O
NaHSO4+NaHSO3═Na2SO4+SO2↑+H2O
;
(4)化合物M由B、D、E三种元素形成,将M溶液逐滴加入到X溶液中,实验的主要现象是
先无沉淀,后出现白色沉淀,且不消失
先无沉淀,后出现白色沉淀,且不消失
,
写出有关反应的离子方程式
Al3++4OH-═AlO2-+2H2O
Al3++4OH-═AlO2-+2H2O
Al3++3AlO2-+6H20═4Al(OH)3↓
Al3++3AlO2-+6H20═4Al(OH)3↓
;
(5)D单质、F单质和X溶液能构成原电池,写出该原电池负极电极反应式样
Al-3e-+4OH-═AlO2-+2H2O
Al-3e-+4OH-═AlO2-+2H2O
;
(6)通常条件下,C的最高价氧化物对应水化物2mol与E最高价氧化物对应水化物1mol和稀溶液间反应放出的热量为114.6KJ,试写出表示该热量变化的离子方程式
H+(aq)+OH-(aq)═H20(l)△H=-57.3KJ/mol
H+(aq)+OH-(aq)═H20(l)△H=-57.3KJ/mol
.
(7)将agD单质、F单质及D、F的氧化物样品溶解在过量的100mL pH=1的E最高价氧化物对应水化物的溶液中,然后向其中加入X溶液使D、F离子刚好完全沉淀,用去X溶液50mL,则X溶液的物质的量浓度为
0.2
0.2
mol?L
-1.
(8)B与C形成的化合物Y呈淡黄色,Y与F的硫酸盐(纯净物)按物质的量之比1:2混合溶于水中,反应的离子方程式可能为
3Na2O2+6Fe2++6H2O═6Na++4Fe(OH)3↓+2Fe3+;6Na2O2+4Fe3++6H2O═12Na++4Fe(OH)3↓+3O2↑
3Na2O2+6Fe2++6H2O═6Na++4Fe(OH)3↓+2Fe3+;6Na2O2+4Fe3++6H2O═12Na++4Fe(OH)3↓+3O2↑
.

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案