
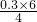 mol=0.45mol,故答案为:0.45;
mol=0.45mol,故答案为:0.45;  ,说明消耗的硝酸多,KI少,可能原因是硝酸浓度角度,被还原为NO2,I被氧化为更高化合价,生成KIO3等,
,说明消耗的硝酸多,KI少,可能原因是硝酸浓度角度,被还原为NO2,I被氧化为更高化合价,生成KIO3等,

 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
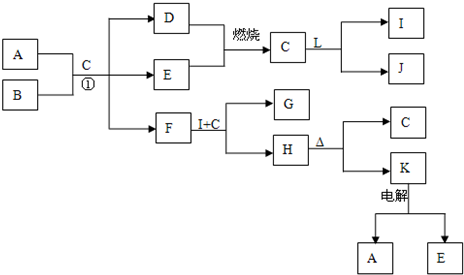
 A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白:
A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
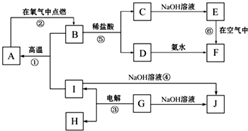
 CaO+CO2 ㈡2CaO+2SO2+O2=2CaSO4
CaO+CO2 ㈡2CaO+2SO2+O2=2CaSO4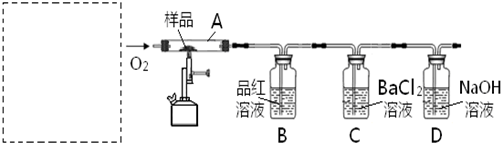
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com