
����Ŀ����ʽ̼��ͭ[Cu2(OH)2CO3]��һ����;�㷺�Ļ���ԭ�ϣ�ʵ�����Է�ͭмΪԭ����ȡ��ʽ̼��ͭ�IJ������£�

����һ����ͭм������ͭ
��ͼ���ý�ͷ�ι���ȡŨHNO3�����ӵ���ƿ�ڵķ�ͭм��(��ͭм����)����ַ�Ӧ����ˣ��õ�����ͭ��Һ��
���������ʽ̼��ͭ���Ʊ�
����Թ��м���̼������Һ������ͭ��Һ��ˮԡ������70�����ң���0.400 mol��L��1��NaOH��Һ����pH��8.5�������ã����ˣ�����ˮϴ�ӣ���ɣ��õ���ʽ̼��ͭ��Ʒ����ش�
��1��ͭ��Ũ���ᷴӦ�����ӷ���ʽ ��
��2����ͼװ����NaOH��Һ�������� ��
��3���������ϴ�ӵ�Ŀ���� ��
��4����ʵ��õ�2.42 g��Ʒ(ֻ��CuO����)��ȡ����Ʒ�������ֽ���ȫ�õ�1.80 g���壬����Ʒ�м�ʽ̼��ͭ������������ ��
���𰸡���1��Cu+4H++2NO3=Cu2++2NO2��+2H2O��
��2�����յ�����������ֹ��Ⱦ������
��3����ȥ��Ʒ���������(NaNO3)����4��91.7%��
��������
�����������1��ͭ��Ũ���ᷴӦ��������ͭ��NO2��H2O�����ӷ�Ӧ����ʽΪ��Cu��4H����2NO3��=Cu2����2NO2����2H2O��(2)����NOx�ж����Ի�������Ⱦ����˱����ȥ���������������������յ��������ֹ��Ⱦ������(3)���˺�Ʒ���溬��NaNO3��NaNO3�Բ�Ʒ�����������IJⶨ������Ӱ�죬�����ȥ��ϴ�ӵ�Ŀ���dz�ȥ��Ʒ��������ʣ�
(4)Cu2(OH)2CO3=2CuO��CO2����H2O ��m
222 62
m(Cu2(OH)2CO3) 2.42-1.8
���m(Cu2(OH)2CO3)=2.22g����������Ϊ2.22/2.42��100%=91.7%��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��M��Q��R��6�ֶ�����Ԫ�أ���ԭ�Ӱ뾶����Ҫ���ϼ����£�
Ԫ�ش��� | X | Y | Z | M | Q | R |
ԭ�Ӱ뾶/nm | 0.160 | 0.143 | 0.102 | 0.075 | 0.077 | 0.037 |
��Ҫ���ϼ� | ��2 | ��3 | ��6����2 | ��5����3 | ��4����4 | ��1 |
��1��Z��Ԫ�����ڱ��е�λ����___________________________________________��
��2��Ԫ��Q��R�γɵĻ�����A�ǹ�ʵ���������A�Ʊ��Ҵ��Ļ�ѧ����ʽ��_________��
��3������ͭ��Ԫ��M������������Ӧˮ�����ϡ��Һ������Ӧ�����ӷ���ʽΪ______________________________________________________________________��
��4��Ԫ��X�Ľ����Ա�Ԫ��Y___���ǿ��������������ԭ�ӽṹ��֪ʶ����ԭ��___________��
��5��Ԫ��Q��Ԫ��Z�ĺ���Ӱ��������ܣ�������ͼװ��A�ڸ����½�������Ԫ��Q��Ԫ��Zת��ΪQO2��ZO2��
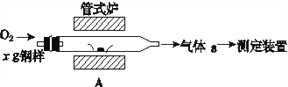
������a�ijɷ���________________���ѧʽ����
����������Ԫ��Z��FeZ����ʽ���ڣ���A�з�Ӧ����ZO2���ȶ��ĺ�ɫ�������Ӧ�Ļ�ѧ����ʽ��_______________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������һ���������������Ⱦ�Ϲ�ҵ��ij��ȤС�����Ʊ�Ca(NO2)2���������ʽ���̽����
�������زġ�
I��NO+NO2+Ca(OH)2=Ca(NO2)2+H2O��
��Ca(NO2)2�ܱ�����KMnO4��Һ������NO3-��MnO4-����ԭΪMn2+��
�������������£�Ca(NO2)2�ܽ�I-����ΪI2��S2O32-�ܽ�I2��ԭΪI-��
���Ʊ��������
(1)����ͬѧ������������ͼ��ʾװ���Ʊ��������
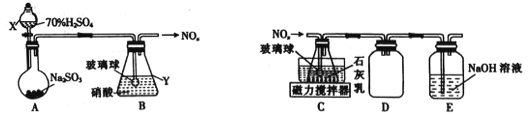
������X��Y�����Ʒֱ���______________��______________��
��װ��B���ݳ���NO��NO2�����ʵ���֮��Ϊ1��1,��װ��B�з�����Ӧ�Ļ�ѧ����ʽΪ_____________________ ���������������䣬���������Ũ�ȣ����ʹ�ݳ���������n(NO2)__________n(NO)(�>����<������
���Ʊ�Ca(NO2)2��
������ͬѧ������װ��B�в����ĵ��������Ʊ�Ca(NO2)2��װ��������ͼ��
��װ��C�е���ĩ�˽�һ�������������________________��
��װ��D��������______________��װ��E��������________________��
���ⶨCa(NO2)2�Ĵ��ȡ�
�DZ���ͬѧ��ⶨCa(NO2)2�Ĵ���(���ʲ��μӷ�Ӧ)���ɹ�ѡ����Լ���
a��ϡ���� b�� c1mol��L-1��KI��Һ c��������Һ
d��c2mol��L-1��Na2S2O3��Һ e��c3mol��L-1 ������ KMnO4 ��Һ
������Ca(NO2)2�Ļ�ԭ�����ⶨ�䴿�ȣ���ѡ����Լ���______________(����ĸ)��
������Ca(NO2)2�����������ⶨ�䴿�ȵIJ��裺ȷ��ȡmgCa(NO2)2��Ʒ������ƿ�У�������ˮ�ܽ⣬__________________(�벹������ʵ�鲽��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Һ������������ԭ��Ӧ�����ܴ����������
A��H+��NO3-��Fe2����Na+ B��Ag+��K+��I-��Cl-
C��K+��Ba2+��OH-��SO42- D��K+��Cu2+��Br-��OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���������������������أ������й�˵����ȷ����
A. �����pH��5.67.0֮��
B. Al(OH)3��������������
C. ���ڹ���ͨ�ŵĹ��ά������������ľ�����ά�����������ǽ�������
D. �ø��������Һ���ƾ���˫��ˮ��ǿ�����Խ���ɱ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����Ҫ����ۡ������ͺͼ����屺�ƶ��ɡ�����˵����ȷ����
A. �ø�㲻����������
B. �����������ǻ�Ϊͬ���칹��
C. ���ۡ���֬�͵����ʶ���ˮ��
D. ���ۡ���֬�͵����ʶ��Ǹ߷��ӻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ΪԪ�����ڱ��е�һ���֣�
��֪���ݵ��⻯�ﳣ����Ϊ���壬�������ʹʪ��ĺ�ɫʯ����ֽ������
�û�ѧʽ��Ԫ�ط��Żش��������⣺
(1) �������ڱ��е�λ��_______��
(2) �٢ڢ��У�����������Ӧ��ˮ���������ǿ�����ʵĵ���ʽΪ_________��
(3) �٢ڢļ����Ӱ뾶�ɴ�С��˳����___________���������ӷ��ţ�
(4) ��һ����ѧ����ʽ֤��ClԪ����߷ǽ����Ե�ǿ����____________��
(5) �ٺ͢��γɵ�һ�ֻ�����A�к���һ��10��������һ��18����������A�к��еĻ�ѧ������Ϊ______��
(6) �ޡ��߷ֱ��γɵ��⻯��е�ߵ���_______���ѧʽ����ԭ����_______��
(7) �١��۷ֱ��γɵ�����������Ӧ��ˮ�������Ӧ�����ӷ���ʽΪ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʰ����������ǿ����ʺͷǵ����˳�����е��ǣ� ��
A. ����������������������Լء�H2S��
B. ������Ư�ۡ������ơ�������
C. ������ˮú�������ᡢͭ
D. �����ᡢ�������֡����ᱵ���Ҵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж�������ɫ˵������ȷ���ǣ� ��
A.Cu2+ ��ɫ
B.MnO4���Ϻ�ɫ
C.Na+��ɫ
D.Fe3+�ػ�ɫ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com