
| 元素 | 相关信息 |
| A | 该元素的一种核素无中子 |
| B | 基态原子核外只有三个能级,且各能级电子数相等 |
| C | 基态原子最外层电子数是其内层电子总数的2.5倍 |
| D | 一个D-离子含18个电子 |
| E | +3价离子3d能级为半充满 |
分析 常见元素A、B、C、D、E的原子序数依次增大,A元素的一种核素无中子,则A为H元素;
B的基态原子核外只有三个能级,且各能级电子数相等,则B原子核外电子排布为1s22s22p2,则B为C元素;
C的基态原子最外层电子数是其内层电子总数的2.5倍,则C原子核外有2个电子层,最外层电子数为5,则C为N元素;
D的一个D-离子含18个电子,则D原子核外电子总数=核电荷数=17,为Cl元素;
E3+的3d能级为半充满,其基态原子的电子排布式为:1s22s22p63s23p63d64s2或[Ar]3d64s2,为Fe元素,
根据以上分析进行解答.
解答 解:常见元素A、B、C、D、E的原子序数依次增大,A元素的一种核素无中子,则A为H元素;B的基态原子核外只有三个能级,且各能级电子数相等,则B原子核外电子排布为1s22s22p2,则B为C元素;C的基态原子最外层电子数是其内层电子总数的2.5倍,则C原子核外有2个电子层,最外层电子数为5,则C为N元素;D的一个D-离子含18个电子,则D原子核外电子总数=核电荷数=17,为Cl元素;E3+的3d能级为半充满,其基态原子的电子排布式为:1s22s22p63s23p63d64s2或[Ar]3d64s2,为Fe元素,
(1)E为Fe元素,其基态核外电子排布式为:1s22s22p63s23p63d64s2,铁元素位于第4周期第VIII族,基态原子未成对电子为3d轨道的4个电子,
故答案为:第4周期第VIII族;4;
(2)B、C、D分别为C、N、Cl元素,非金属性越强,电负性越强,则电负性大小为:Cl>N>C,
故答案为:Cl>N>C;
(3)C单质为N2,N2分子含氮氮三键,δ键和π键的个数比为1:2;由于氨分子间存在氢键,故使其沸点出现反常,
故答案为:1:2;NH3分子间易形成氢键;
(4)D的氢化物为HCl,其最高价氧化物的水化物的钾盐为KClO4,共热能发生反应,生成一种气体单质,应为Cl2,反应的方程式为:8HCl+KClO4$\frac{\underline{\;\;△\;\;}}{\;}$KCl+4Cl2↑+4H2O,
故答案为:8HCl+KClO4$\frac{\underline{\;\;△\;\;}}{\;}$KCl+4Cl2↑+4H2O;
(5)由A、B两种元素组成的含4个原子的非极性分子为乙炔,乙炔的电子式为 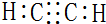 ;
;
已知乙炔的燃烧热为1200kJ∕mol,则乙燃烧热的热化学反应方程式为C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l);△H=-1200 kJ/mol,故答案为: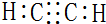 ;C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l);△H=-1200 kJ/mol;
;C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l);△H=-1200 kJ/mol;
(6)已知N2(g)+3H2(g)?2NH3(g)△H=-akJ/mol,其表达式为:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$;
恒温恒容下,2molNH3完全转化到左边,可得3molH2和1molN2,故与原平衡为等效平衡,平衡时NH3的浓度相同,令平衡时氮气的物质的量为ymol,向容器中充入1molN2和3molH2,平衡时参加反应的氮气为(1-y)mol,根据N2(g)+3H2(g)?2NH3(g);△H=-akJ/mol,可知放出的热量为(1-y)mol×akJ/mol=a(1-y)kJ,即a(1-y)=b,
向容器中充入2molNH3,到达平衡时,生成氮气ymol,根据N2(g)+3H2(g)?2NH3(g);△H=-akJ/mol,可知吸收的热量为ymol×akJ/mol=aykJ,即c=ay,所以a=b+c,
故答案为:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$;a=b+c.
点评 本题考查结构性质位置关系应用,题目难度中等,涉及电负性、电离能、方程式的书写、化学平衡的计算等知识,注意掌握原子结构与元素周期表、元素周期律的关系,(6)为易错点,注意等效平衡原理的应用.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 测定某二元弱酸钠盐溶液的pH,可能小于7 | |
| B. | 稀释0.1mol/LCH3COOH(aq),$\frac{c(O{H}^{-})c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$可能变大也可能变小 | |
| C. | 在20.00ml浓度均为0.100 mol/L的HCl与CH3COOH混合溶液中滴加0.200mol/LNaOH溶液至pH=7,NaOH溶液体积一定小于20.00ml | |
| D. | pH=8的碱性溶液中一定没有CH3COOH分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用 pH 试纸检验气体,一般先将 pH试纸用蒸馏水湿润,粘在玻璃棒的一端,并使其接近出气口,观察颜色的变化 | |
| B. | 检验 Fe3O4中是否含+2价铁元素时,先用盐酸溶解Fe3O4,再用 KMnO4溶液检验 | |
| C. | 海带中碘元素的提取和检验实验中为制取海带灰的浸取液,需要煮沸1-2min,其主要目的是赶走溶液中的溶解氧,避免氧气氧化碘离子 | |
| D. | 检验麦芽糖水解的产物时,先向水解后的溶液中加入氢氧化钠溶液至碱性,再加入新制的银氨溶液并水浴加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中氢气做还原剂,铝做氧化剂 | |
| B. | 在空气中Al2O3比 B2H6更稳定 | |
| C. | B2H6中存在极性键、非极性键、离子键 | |
| D. | 每生成1mol B2H6要消耗2molAlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 Mn.Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
Mn.Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:| 元素 | Mn | Fe | |
| 电离能 KJ/mol | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
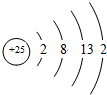 ,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,对此,你的解释是由Mn2+转化为Mn3+时,3d能经由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态);
,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,对此,你的解释是由Mn2+转化为Mn3+时,3d能经由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态);查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷与甲烷互为同系物 | |
| B. | 通常条件下,丙烷性质稳定,不与酸、碱和氧化剂发生反应 | |
| C. | 丙烷燃烧是吸热反应 | |
| D. | 火炬燃料用丙烷比用煤油更环保 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
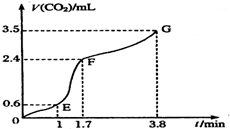 现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题:
现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com