
| A、粗盐提纯时,为了加快过滤速率,可用玻璃棒搅拌漏斗中的液体 |
| B、分液操作中,将下层液体放入一烧杯后,再将上层液体继续放入另一烧杯中 |
| C、蒸发KNO3溶液时,当蒸发皿中出现大量晶体时即停止加热,用余热蒸干剩余的水分,获取KNO3晶体 |
| D、蒸馏操作中,温度计水银球部位要插入液面下且不接触蒸馏烧瓶壁 |


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
| A、卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深 |
| B、氧族元素氢化物稳定性按H2O、H2S、H2Se、H2Te的顺序依次减小 |
| C、氢化物的沸点按NH3、BiH3、SbH3、AsH3、PH3的顺序依次递减 |
| D、最高价氧化物对应水化物碱性按NaOH、KOH、RbOH、CsOH的顺序依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
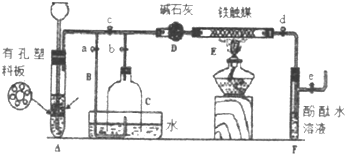
查看答案和解析>>
科目:高中化学 来源: 题型:
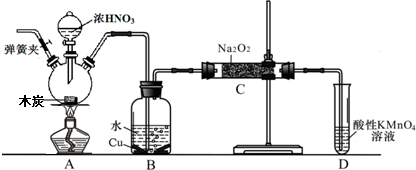
查看答案和解析>>
科目:高中化学 来源: 题型:
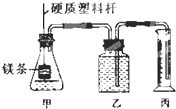 某研究性学习小组为证明在相同条件下,同浓度同体积强弱不同的一元酸与同一种金属反应时,生成氢气的速率不同,同时测定该温度和压强下的气体摩尔体积,设计组装了两套如图所示的简易实验装置.
某研究性学习小组为证明在相同条件下,同浓度同体积强弱不同的一元酸与同一种金属反应时,生成氢气的速率不同,同时测定该温度和压强下的气体摩尔体积,设计组装了两套如图所示的简易实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:
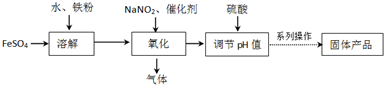
查看答案和解析>>
科目:高中化学 来源: 题型:
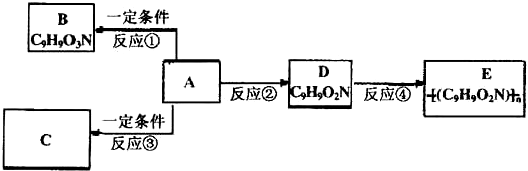
| 反应 | 反应类型 | 反应条件 |
| ② | ||
| A→B |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无色溶液中:Na+、MnO4-、SO42-、K+ |
| B、使蓝色石蕊试纸变红的溶液中:K+、S2-、NO3-、OH- |
| C、加入Al能放出H2的溶液中:K+、NH4+、NO3-、Cl- |
| D、含有大量Fe3+的溶液中:Al3+、Cu2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 0 | 20 | 40 | 60 | 80 | |
| c(N2O4)mol?L-1 | 0.100 | a | 0.050 | c | d |
| c(NO2)/mol?L-1 | 0.000 | 0.060 | b | 0.120 | 0.120 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com