
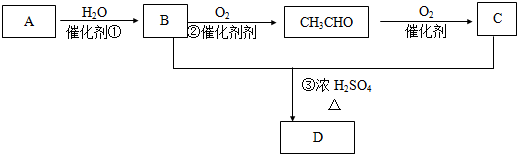
分析 气体A的产量是衡量一个国家石油化工发展水平的标志,所以A是乙烯,结构简式为CH2=CH2,CH2=CH2和水发生加成反应生成乙醇,则B结构简式为CH3CH2OH,CH3CH2OH被氧化生成CH3CHO,CH3CHO被氧化生成C为CH3COOH,CH3CH2OH和CH3COOH发生酯化反应生成D为CH3COOCH2CH3,以此解答该题.
解答 解:气体A的产量是衡量一个国家石油化工发展水平的标志,所以A是乙烯,结构简式为CH2=CH2,CH2=CH2和水发生加成反应生成乙醇,则B结构简式为CH3CH2OH,CH3CH2OH被氧化生成CH3CHO,CH3CHO被氧化生成C为CH3COOH,CH3CH2OH和CH3COOH发生酯化反应生成D为CH3COOCH2CH3,
(1)根据上面的分析可知,A的结构简式为CH2=CH2,
故答案为:CH2=CH2;
(2)反应②为乙醇的催化氧化,反应的方程式为2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O,是氧化反应,反应③为 CH3CH2OH和CH3COOH发生酯化反应生成CH3COOCH2CH3,反应的方程式为CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$ CH3COOC2H5+H2O,也是取代反应,
故答案为:2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O;氧化反应;CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$ CH3COOC2H5+H2O;取代或酯化.
点评 本题考查有机物推断,为高考常见题型,侧重于学生的分析能力的考查,涉及烯烃、醇、醛、羧酸、酯之间的转化,明确有机物中官能团及其性质即可解答,熟练掌握常见有机物反应类型,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 一定有SO${\;}_{4}^{2-}$- | B. | 一定有CO32- | ||
| C. | 不能确定Cl-是否存在 | D. | 不能确定HCO3-是否存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内气体压强不再改变 | |
| B. | 有2mol NH3生成的同时有3mol H2反应 | |
| C. | 生成NH3的量与反应掉N2的量之比为2:1 | |
| D. | N2、H2、NH3的物质的量之比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | |
| B. | CH2═CH2+Br2-→CH2BrCH2Br | |
| C. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| D. | 2CH3CH2OH+O2$→_{△}^{Cu或Ag}$2CH3CHO+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 我国“西气东输”中的“气”指的是石油气 | |
| B. | 废弃物在一定条件下发生化学反应,产生热值较高的可燃性气体,该过程属于生物化学转化 | |
| C. | 煤干馏的主要产物为焦炭、煤焦油、粗氨水和焦炉气 | |
| D. | 石油分馏是化学变化,可得到汽油、煤油等产品 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com