
【题目】硫酸镍广泛应用于电镀、电池、催化剂等工业。某科研小组以粗硫酸镍(含![]() 等)为原料,经如图一系列除杂过程模拟精制硫酸镍工艺。回答下列问题。
等)为原料,经如图一系列除杂过程模拟精制硫酸镍工艺。回答下列问题。
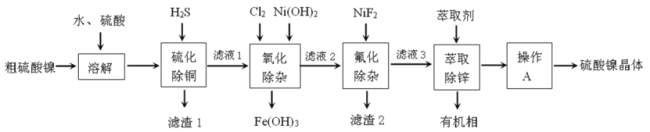
(1)滤渣1的主要成分是__________(写化学式),写出“硫化除铜”过程生成含铜物质反应的离子方程式__________。
(2)“氧化除杂”时加入![]() 和
和![]() 的主要作用是__________。
的主要作用是__________。
(3)已知![]() 时,
时,![]() ;
;![]() 。则“氟化除杂”过后滤液3中
。则“氟化除杂”过后滤液3中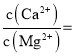 _____。
_____。
(4)“萃取”时使用萃取剂![]() 在硫酸盐中对某些金属离子的萃取率与溶液
在硫酸盐中对某些金属离子的萃取率与溶液![]() 的关系如图。则实验时需控制的
的关系如图。则实验时需控制的![]() 适宜范围是_____(填字母序号)。
适宜范围是_____(填字母序号)。
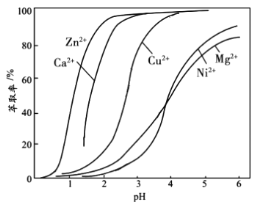
A.1~2 B.3~4 C.4~5 D.5~6
(5)将萃取后所得富含硫酸镍的溶液经操作A可得硫酸镍晶体,则操作A为___、___、过滤、洗涤等。
(6)称取![]() 硫酸镍晶体(
硫酸镍晶体(![]() )样品溶解,定容至
)样品溶解,定容至![]() 。取
。取![]() 试液,用
试液,用![]() 的
的![]() 标准溶液滴定至终点。重复实验,平均消耗
标准溶液滴定至终点。重复实验,平均消耗![]() 标准溶液体积为
标准溶液体积为![]() 。反应为
。反应为![]() 。计算样品纯度为_____。(不考虑杂质反应)
。计算样品纯度为_____。(不考虑杂质反应)
【答案】CuS和S H2S+ Cu2+=CuS↓+2H+ ![]() 的作用是将滤液中Fe2+氧化为Fe3+,
的作用是将滤液中Fe2+氧化为Fe3+,![]() 的作用是调节溶液pH值,使Fe3+转化为氢氧化铁沉淀除去 6.17×10-3 B 蒸发浓缩 降温结晶 96.0%
的作用是调节溶液pH值,使Fe3+转化为氢氧化铁沉淀除去 6.17×10-3 B 蒸发浓缩 降温结晶 96.0%
【解析】
粗硫酸镍(含![]() 等)加水和硫酸进行酸浸溶解,得到含有Ni2+、Cu2+、Fe3+、Ca2+、Mg2+、Zn2+、SO42-等离子的浸出液,向浸出液中通入H2S气体,Cu2+转化为CuS沉淀除去,同时Fe3+可与S2-发生氧化还原反应生成Fe2+和S单质,过滤后得到滤液1和滤渣1,滤渣1为CuS和S,滤液1中含有Ni2+、Fe2+、Ca2+、Mg2+、Zn2+、SO42-,向滤液1中加入Ni(OH)2和Cl2,Cl2将滤液中Fe2+氧化为Fe3+,用Ni(OH)2调节溶液pH值,使Fe3+转化为氢氧化铁沉淀除去,再进行过滤得到滤液2,向其中加入NiF2,使滤液2中的Ca2+、Mg2+转化为CaF2、MgF2沉淀除去,再次进行过滤得到滤液3,向滤液3中加入有机萃取剂,使滤液3中的Zn2+转移至有机相中分液除去,最后对水溶液进行蒸发浓缩、降温结晶、过滤、洗涤等操作得到产品硫酸镍晶体,据此分析解答。
等)加水和硫酸进行酸浸溶解,得到含有Ni2+、Cu2+、Fe3+、Ca2+、Mg2+、Zn2+、SO42-等离子的浸出液,向浸出液中通入H2S气体,Cu2+转化为CuS沉淀除去,同时Fe3+可与S2-发生氧化还原反应生成Fe2+和S单质,过滤后得到滤液1和滤渣1,滤渣1为CuS和S,滤液1中含有Ni2+、Fe2+、Ca2+、Mg2+、Zn2+、SO42-,向滤液1中加入Ni(OH)2和Cl2,Cl2将滤液中Fe2+氧化为Fe3+,用Ni(OH)2调节溶液pH值,使Fe3+转化为氢氧化铁沉淀除去,再进行过滤得到滤液2,向其中加入NiF2,使滤液2中的Ca2+、Mg2+转化为CaF2、MgF2沉淀除去,再次进行过滤得到滤液3,向滤液3中加入有机萃取剂,使滤液3中的Zn2+转移至有机相中分液除去,最后对水溶液进行蒸发浓缩、降温结晶、过滤、洗涤等操作得到产品硫酸镍晶体,据此分析解答。
(1)根据分析,滤渣1的主要成分是CuS和S,“硫化除铜”过程中,向浸出液中通入H2S气体,Cu2+转化为CuS沉淀除去,离子方程式H2S+ Cu2+=CuS↓+2H+;
(2)根据分析,“氧化除杂”时加入Cl2将滤液中Fe2+氧化为Fe3+,用Ni(OH)2调节溶液pH值,使滤液1中的Fe3+转化为氢氧化铁沉淀除去;
(3)已知![]() 时,
时,![]() ;
;![]() 。则“氟化除杂”过后滤液3中
。则“氟化除杂”过后滤液3中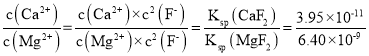 =6.17×10-3;
=6.17×10-3;
(4)在该工艺流程中,“萃取”操作的目的是使滤液3中的Zn2+转移至有机相中分液除去,流程的最终目的是制得硫酸镍,结合金属离子的萃取率与溶液![]() 的关系如图所示,当控制实验时的
的关系如图所示,当控制实验时的![]() 为3~4左右可以使滤液中的Cu2+、Ca2+、Zn2+等离子的萃取除杂率最好,故答案选B;
为3~4左右可以使滤液中的Cu2+、Ca2+、Zn2+等离子的萃取除杂率最好,故答案选B;
(5)根据分析,将萃取后所得富含硫酸镍的溶液经操作A可得硫酸镍晶体,则操作A为蒸发浓缩、降温结晶、过滤、洗涤等操作得到产品硫酸镍晶体;
(6)根据题意,取![]() 试液,消耗EDTA标准液的物质的量=0.02mol/L×0.0365L=7.3×10-4mol,根据反应
试液,消耗EDTA标准液的物质的量=0.02mol/L×0.0365L=7.3×10-4mol,根据反应![]() ,25mL试液中n(Ni2+)=n(EDTA)= 7.3×10-4mol,则250mL试液中硫酸镍晶体的质量=
,25mL试液中n(Ni2+)=n(EDTA)= 7.3×10-4mol,则250mL试液中硫酸镍晶体的质量=![]() ×7.3×10-4mol×263=1.9199g,则样品纯度为=
×7.3×10-4mol×263=1.9199g,则样品纯度为=![]() ×100%≈96%。
×100%≈96%。


科目:高中化学 来源: 题型:
【题目】a、b、c、d是四种短周期的主族元素。a、b、d同周期,其中d的质子数最大;a、c同主族。a的原子结构示意图为: ;a与b形成化合物的电子式为:
;a与b形成化合物的电子式为:![]() 。下列叙述正确的是( )
。下列叙述正确的是( )
A.原子半径:a>c>d
B.相应氢化物的沸点:d>c>a
C.非金属性:c>a>d
D.c与a、c与b均能形成两种常见化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据化学能和热能、电能相关的知识,请回答下列问题:
I.已知31 g白磷(P4)变为31 g红磷(P)时释放能量。上述变化属于_____变化;稳定性白磷_____红磷(填“>”或“<”);
II.氢气是一种清洁能源,在我国航天工程中也有应用。
(1)已知:2H2+O2![]() 2H2O。该反应1g氢气完全燃烧放出热量121kJ,其中断裂1molH—H键吸收436kJ,断裂1molO=O键吸收496kJ,那么形成1molH—O键放出热量_______________。
2H2O。该反应1g氢气完全燃烧放出热量121kJ,其中断裂1molH—H键吸收436kJ,断裂1molO=O键吸收496kJ,那么形成1molH—O键放出热量_______________。
(2)航天技术上使用的氢-氧燃料电池原理可以简单看作下图“氢-氧燃料电池的装置图” 则:

①a极为电池的______(填“正极”或“负极”);溶液中OH-移向_______电极(填“a”或“b”)。
②b电极附近pH_______。(填增大、减小或不变)。
③如把H2改为甲烷,则电极反应式为:负极_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 和
和![]() 为原子序数依次增大的短周期元素,
为原子序数依次增大的短周期元素,![]() 同主族且能形成离子化合物,
同主族且能形成离子化合物,![]() 的最外层电子数是
的最外层电子数是![]() 质子数之和的一半,
质子数之和的一半,![]() 原子的核外电子数为偶数。四种元素组成的一种化合物
原子的核外电子数为偶数。四种元素组成的一种化合物![]() 具有下列性质。下列说法正确的是( )
具有下列性质。下列说法正确的是( )
白色沉淀![]() M
M![]() 溶液褪色并产生气泡
溶液褪色并产生气泡
A.原子半径:![]()
B.![]() 使溴水褪色体现氧化性
使溴水褪色体现氧化性
C.简单氢化物的稳定性:![]()
D.![]() 与
与![]() 均能形成具有漂白性的物质
均能形成具有漂白性的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写不正确的是( )
A.钠与水反应:Na+H2O=Na++OH-+H2↑
B.氯化钡溶液与稀硫酸反应:Ba2++SO![]() =BaSO4↓
=BaSO4↓
C.碳酸钠溶液与足量盐酸反应:CO![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
D.铜与稀硝酸反应:3Cu+8H++2NO![]() =3Cu2++2NO↑+4H2O
=3Cu2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铜及其化合物应用广泛。回答下列问题:
(1)基态铁原子核外最后一个电子填充在__________(填能级符号),含有__________个成单电子,具有磁性。
(2)铁氰化钾![]() 是检验
是检验![]() 的重要试剂。
的重要试剂。
①铁氰化钾中,所涉及的元素的第一电离能由大到小的顺序为__________。
②铁氰化钾中,不存在__________(填字母标号)。
A.离子键 B.σ键 C.π键 D.氢键 E.金属键
(3)血蓝蛋白是某些节肢动物体内能与氧气可逆结合的一种铜蛋白,其部分结构示意图如图。其中![]() 的化合价为_______价,
的化合价为_______价,![]() 的杂化类型是__________。
的杂化类型是__________。
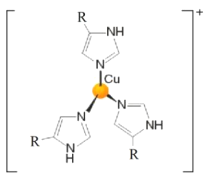
(4)![]() 合金可看作由如图所示的(a)、(b)两种原子层交替堆积排列而成。图中虚线构建的六边形,表示由这两种层平行堆积时垂直于层的相对位置;(c)是由(a)和(b)两种原子层交替堆积成
合金可看作由如图所示的(a)、(b)两种原子层交替堆积排列而成。图中虚线构建的六边形,表示由这两种层平行堆积时垂直于层的相对位置;(c)是由(a)和(b)两种原子层交替堆积成![]() 合金的晶体结构图。在这种结构中,同一层的
合金的晶体结构图。在这种结构中,同一层的![]() 距离为
距离为![]() 。
。

①![]() 合金中
合金中![]() __________。
__________。
②同一层中,![]() 原子之间的最短距离是__________
原子之间的最短距离是__________![]() ,设
,设![]() 为阿伏加德罗常数的值,若要求算
为阿伏加德罗常数的值,若要求算![]() 晶体的密度,还需要知道的物理量是_________(钙、铜元素的相对原子质量为已知量)。
晶体的密度,还需要知道的物理量是_________(钙、铜元素的相对原子质量为已知量)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用如图所示装置探究氨气的性质。

请回答:
(1)实验室用NH4Cl和Ca(OH)2共热制取氨气,该反应的化学方程式是_____。
(2)①中湿润的红色石蕊试纸变蓝,说明氨气的水溶液显______(填字母)。
a.碱性 b.还原性
(3)向②中滴入浓盐酸,现象是_____。
(4)下列装置中,能用于本实验中尾气吸收的是______(填字母)。
a. b.
b.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示,已知其燃烧时P被氧化为P4010,下列有关P4S3的说法中不正确的是

A. P4S3属于共价化合物
B. 1mol P4S3分子中含有9mol共价键
C. P4S3充分燃烧的化学方程式为P4S3+8O2=P4O10+3SO2
D. P4S3中磷元素为+3价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象与结论均正确的是( )
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 向未知液中滴加氯水,再滴加KSCN溶液 | 溶液呈红色 | 未知液中一定含有Fe2+ |
B | 向未知溶液中,先加入氢氧化钠溶液,加热,用润湿的红色石蕊试纸靠近。 | 试纸变蓝 | 无色溶液中含有NH |
C | 向某溶液中加入氯化钡溶液 | 有白色沉淀生成 | 该溶液中一定含有SO |
D | 将银白色的金属钠放置在空气中 | 钠表面很快变暗 | 金属钠具有强氧化性 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com