


科目:高中化学 来源: 题型:
| A、物质的量(n) |
| B、摩尔质量(M) |
| C、物质的量浓度(c) |
| D、质量分数(ω) |
查看答案和解析>>
科目:高中化学 来源: 题型:
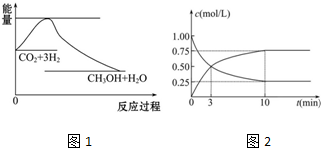
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、保持温度和容器体积不变,充入1mol SO3(g) |
| B、保持温度和容器内压强不变,充入1mol SO3(g) |
| C、保持温度和容器内压强不变,充入1mol O2(g) |
| D、保持温度和容器内压强不变,充入1mol Ar(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu2+>Fe3+>Fe2+>Zn2+ |
| B、Fe3+>Cu2+>Fe2+>Zn2+ |
| C、Fe3+>Fe2+>Cu2+>Zn2+ |
| D、Zn2+>Fe2+>Cu2+>Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、样品中含有少量Na2O杂质 |
| B、容量瓶中原来有少量蒸馏水 |
| C、定容时观察液面仰视 |
| D、未冷却至室温直接把NaOH溶液移入容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、四种溶液中c(HA-)浓度大小:③>①>②>④ |
| B、溶液①中粒子浓度大小顺序是:c(H2A)>c(H+)>c(HA-)>c(A2-)>c(OH-) |
| C、溶液②中有关离子浓度关系:c(HA-)+2c(A2-)+c(H2A)=c(Na+) |
| D、溶液③中有关离子浓度关系:c(HA-)+c(A2-)+c(OH-)=c(Na+)+c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com