
 某浓硫酸,标签如图所示.现用该浓硫酸配制100mL 1mol/L的稀硫酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.
某浓硫酸,标签如图所示.现用该浓硫酸配制100mL 1mol/L的稀硫酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.| 1000ρw |
| M |
| 1000×1.84×98% |
| 98 |
| 1mol/L×0.1L |
| 18.4mol/L |


科目:高中化学 来源: 题型:阅读理解
 用18mol/L的浓硫酸配制80mL 1.0mol/L的稀硫酸,需用的实验仪器有:A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
用18mol/L的浓硫酸配制80mL 1.0mol/L的稀硫酸,需用的实验仪器有:A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶查看答案和解析>>
科目:高中化学 来源: 题型:
 熟悉实验仪器,能正确进行实验操作是做好化学实验的前提.
熟悉实验仪器,能正确进行实验操作是做好化学实验的前提.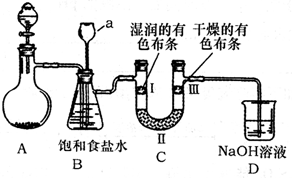
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室里要配制400mL0.2mol/L的硫酸钠溶液.实验步骤大致有:
实验室里要配制400mL0.2mol/L的硫酸钠溶液.实验步骤大致有:查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制100mL 1mol?L-1的稀硫酸.
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制100mL 1mol?L-1的稀硫酸.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com