
����Ŀ����֪��A��ʯ���ѽ�������Ҫ����֮һ������������ں���һ��ʯ�ͻ�����չˮƽ�ı�־���������л���A��G֮���ת����ϵ��
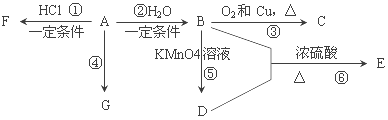
��ش��������⣺
��1��A�Ĺ����ŵ�������______________________��C�Ľṹ��ʽ��______________��
��2��E��һ�־�����ζ��Һ�壬��B+D���ķ�Ӧ����ʽΪ___________���÷�Ӧ������______________��
��4��G��һ�ָ߷��ӻ������ṹ��ʽ��______________��
��4�������У����˶�Ա������˻�Ť��ʱ�����ҽ���������˲�λ��������F���е�12.27��C������Ӧ��������д����A��F�Ļ�ѧ��Ӧ����ʽ______________��
���𰸡���1��̼̼˫����1�֣���CH3CHO��2��������2��CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O��2������������Ӧ(��ȡ����Ӧ) ��1�֣�
CH3COOCH2CH3+H2O��2������������Ӧ(��ȡ����Ӧ) ��1�֣�
��3��![]() ��2��������4��CH2=CH2+HCl
��2��������4��CH2=CH2+HCl![]() CH3CH2Cl��2����
CH3CH2Cl��2����
��������
���������A��ʯ���ѽ�������Ҫ�ɷݣ����IJ���ͨ����������һ������ʯ�ͻ���ˮƽ��A����ϩ����ϩ��ˮ�����ӳɷ�ӦCH2=CH2+H2O![]() CH3CH2OH����B����B���Ҵ����Ҵ���������ͭ�����������´���Ӧ����C��2CH3CH2OH+O2
CH3CH2OH����B����B���Ҵ����Ҵ���������ͭ�����������´���Ӧ����C��2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O����C����ȩ���Ҵ��ڸ����������������D��2C2H5OH+2KMnO4+5H2SO4=K2SO4+2MnSO4+2CH3COOH+7H2O��D�����ᣬ�Ҵ���������Ũ���������·�Ӧ��CH3CH2OH+CH3COOH
2CH3CHO+2H2O����C����ȩ���Ҵ��ڸ����������������D��2C2H5OH+2KMnO4+5H2SO4=K2SO4+2MnSO4+2CH3COOH+7H2O��D�����ᣬ�Ҵ���������Ũ���������·�Ӧ��CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O��������������E��G��һ�ָ߷��ӻ������A��ϩ�Ӿ۶���Ϊ����ϩ��FΪA��ϩ���Ȼ���ӳɶ���CH2=CH2+HC1��CH3CH2C1��Ϊ�����飻
CH3COOCH2CH3+H2O��������������E��G��һ�ָ߷��ӻ������A��ϩ�Ӿ۶���Ϊ����ϩ��FΪA��ϩ���Ȼ���ӳɶ���CH2=CH2+HC1��CH3CH2C1��Ϊ�����飻
��1��AΪ��ϩ���ṹ��ʽΪ��CH2=CH2������̼̼˫����A����ϩ��B���Ҵ����Ҵ���������ͭ�����������´���Ӧ����C����C����ȩ��C�Ľṹ��ʽΪCH3CHO��
��2��E��һ�־�����ζ��Һ�壬Ϊ����������B���Ҵ���B�Ҵ��ڸ����������������D��D�����ᣬ�Ҵ���������Ũ���������·���������Ӧ��CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O��
CH3COOCH2CH3+H2O��
��3���߷��ӻ��������ظ����ֵĽṹ��Ԫ�����ڣ�G��һ�ָ߷��ӻ������A��ϩ�Ӿ۶���Ϊ����ϩ����ṹ��ʽΪ![]() ��
��
��4��FΪA��ϩ���Ȼ��ⷴӦ�IJ����ϩ���Ȼ�����һ�������·����ӳɷ�Ӧ���������飬����ʽΪ��CH2=CH2+HCl��CH3CH2Cl��������е�͡��ӷ���ʹ���˲�λƤ�������¶���Ȼ�½����ܼ�����Ա��ʹ�С�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������þMg(ClO3)2]����������������ݼ��ȣ�ʵ�����Ʊ�����Mg(ClO3)2��6H2O���������£�
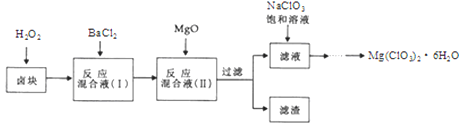
��֪��
��.±����Ҫ�ɷ�ΪMgCl2��6H2O������MgSO4��FeCl2�����ʡ�
��.���ֻ�������ܽ�ȣ�S�����¶ȣ�T���仯������ͼ��ʾ���ش��������⣺
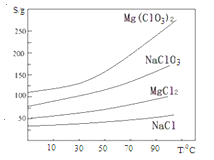
��1��.����ʱ��Ҫ�IJ���������
��2��.����BaCl2��Ŀ���dz�ȥ�������ӣ������ѳ�����ȫ�ķ�����
��3��.����H2O2��Һ�������ǣ� ������MgO��������
��4��.��������Ҫ�ɷ�Ϊ ��
��5��.����Һ�м���NaClO3������Һ������Ӧ�Ļ�ѧ����ʽΪ��MgCl2 + 2NaClO3 = Mg(ClO3)2�� + 2NaCl���ٽ�һ����ȡMg(ClO3)2��6H2O��ʵ�鲽������Ϊ�� ���ڳ��ȹ��ˣ��� ���ܹ��ˡ�ϴ�ӡ����
��6).��Ʒ��Mg(ClO3)2��6H2O�����IJⶨ��
����1��ȷ����3.50 g��Ʒ���100 mL��Һ��
����2�� ȡ10.00 mL����ƿ�У�����10.00 mLϡ�����20.00mL 1.000 mol��L��1��FeSO4��Һ���ȡ�
����3����ȴ�����£���0.l000 mol��L��1K2Cr2O7��Һ�ζ�ʣ���Fe2+���յ㣬�˹����з�Ӧ�����ӷ���ʽΪ��Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ +6Fe3++7H2O��
����4��������2��3�ظ����Σ������ƽ������K2Cr2O7��Һ15.00 mL��
��д������2�з�����Ӧ�����ӷ���ʽ����ԭ����ΪCl����
�ڲ�Ʒ��Mg(ClO3)2��6H2O����������Ϊ ��Mg(ClO3)2��6H2O����Է�������Ϊ299���г�����ʽ���ɣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(8��)A��B��C��D��E��F��GΪԭ���������ε�����7�ֶ���������Ԫ�ء�A��BԪ�ص��������������۵Ĵ����;�Ϊ�㣻CԪ����ֲ����������Ӫ��Ԫ��֮һ��D�ĵ��ʾ���ǿ�����ԣ�D���⻯���γɵ��᳣���ڵ�̲�����Eԭ�Ӻ���K���������M���������ȣ�Fԭ�ӵļ۵��������ڵ��Ӳ�������������ش��������� ��
��1��CD3�ĵ���ʽΪ______________��
��2�������ӷ���ʽ��ʾG�ķǽ����Ա�Fǿ______________��
��3��C��E�γɵĻ������ܽ���ˮ�еķ�Ӧ����ʽΪ______________��
��4��C���⻯����G�ĵ��������ʵ���֮��1��3��Ӧ�����ɶ�Ԫ������X��һ�����壬����������������������������X�Ļ�ѧ��Ϊ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Һ���ܴ��������һ�����ӻ�����ǣ�������
A. NH4+��H+��NO3����HCO3�� B. K+��Al3+��SO42����NH3H2O
C. Na+��K+��SO32����Cl2 D. Na+��CH3COO����CO32����OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ����ȷ����
A��NaHCO3��NaOH��Һ��Ӧ��HCO3-��OH-===CO32-��H2O
B��������ˮ��Ӧ��Cl2��H2O ![]() 2H+��Cl����ClO��
2H+��Cl����ClO��
C���Ȼ�����Һ�м��������İ�ˮ��Fe3+ �� 3NH3��H2O = Fe(OH)3 ��+ 3NH4+
D��ʢ�ż����Լ�����Һ�����ò�������ԭ��SiO2��2OH��===SiO32-+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������֣�NASA������ŵ��ʿ�ҵ���һ�ֱȶ�����̼��Ч104����������������������ȫ�����飨C3F8������������������һ�������ʹ���Ϊ�ڶ�������ļƻ����й�ȫ�������˵����ȷ���� �� ��
A. ����������̼ԭ�ӿ��ܴ���ͬһֱ����
B. ȫ������ĵ���ʽΪ��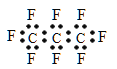
C. ��ͬѹǿ�£��е㣺C3F8��C3H8
D. ȫ����������м��м��Լ����зǼ��Լ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10�֣�A��FΪ���л�ѧ�������������ʣ��Ҷ�����һ����ͬԪ�أ��������Ĺ�ϵ��ͼ��ʾ����֪A��B��C��D��E�Dz�ͬ�������ʣ�C�׳ƴ��F�������к����������ʣ������ַ�Ӧ������P��Ӧ��������ȥ��
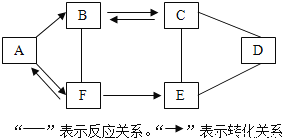
��ش�
��1��д��A��D��F�Ļ�ѧʽ��A______��D______ ��F________��
��2��д��C���ʵ�һ����;___________��C��E��Ӧ�Ļ�ѧ����ʽ��___________��
��3��ͼ��������䷢���ķ�Ӧ��δ�漰�Ļ�����Ӧ������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����Ƿ��Է�����( )
A��ˮ�ɸߴ���ʹ��� B����Ȼ����ȼ��
C�����ڳ�ʪ�Ŀ��������� D��ˮ�������½��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com