
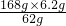 =16.8g,
=16.8g,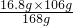 =10.6g,
=10.6g,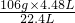 =21.2g
=21.2g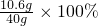 =26.5%,
=26.5%,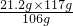 =23.4g,
=23.4g,

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:





查看答案和解析>>
科目:高中化学 来源:2014届河南省高一第二次月考化学试卷(解析版) 题型:选择题
下列反应中,不属于氧化还原反应的是
A.2Na+2H2O=2NaOH+ H2↑
B.2Na2O2+2 CO2=2 Na2CO3+ O2
C.NaH+ H2O = NaOH+ H2↑
D.ICl+H2O=HCl+HIO (ICl中Cl为-1价)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com