
用实验确定某酸HA是弱电解质。两同学的方案是:
甲:①称取一定质量的HA配制0.1 mol·L-1的溶液100 mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是________________。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH______1(填“>”、“<”或“=”)。
乙方案中,说明HA是弱电解质的现象是____________(多选扣分)。
①装HCl溶液的试管中放出H2的速率快;
②装HA溶液的试管中放出H2的速率快;
③两个试管中产生气体的速率一样快。
(3)请你评价:乙方案中难以实现之处和不妥之处:
________________________________________________________________________、
________________________________________________________________________。
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述:________________________________________________________________________
________________________________________________________________________。
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
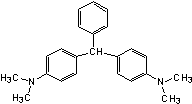 无色孔雀石绿(结构简式如图所示)曾被用作水产养殖业的
无色孔雀石绿(结构简式如图所示)曾被用作水产养殖业的
杀虫剂(鱼药)。因为具有潜在致癌性,已被禁止用作
鱼药。下列关于无色孔雀石绿的叙述中,正确的是
A.分子中所有的碳原子可能在同一平面上
B.无色孔雀石绿属于烃的衍生物
C.无色孔雀石绿可与溴水中的溴发生加成反应
D.在一定条件下,1 mol无色孔雀石绿可以和9 mol氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
现有下列各化合物:
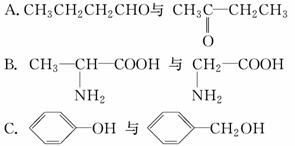
D.CH3CH2C≡CH与CH2===CH—CH===CH2
(1)上述化合物中的含氧官能团是(写名称)________、________、________、________;
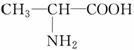 (2)B中的两种氨基酸混合后在一定条件下发生缩合反应生成的二肽最多有________种,与 互为同分异构体的硝基化合物有________种。
(2)B中的两种氨基酸混合后在一定条件下发生缩合反应生成的二肽最多有________种,与 互为同分异构体的硝基化合物有________种。
(3)鉴别C中的两种有机物可选用的试剂为________。
(4)D中两化合物的名称分别是________、________;写出CH2===CH—CH===CH2发生聚合反应的化学方程式
________________________________________________________________________。
(5)上述化合物中属于同分异构体的是________,属于同系物的是________(填字母代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
醛可以跟亚硫酸氢钠的饱和溶液发生加成反应,生成 物是水溶性的α羟基磺酸钠:
物是水溶性的α羟基磺酸钠:

反应 是可逆的,在通常条件下有70%~90%向正反应方向转化。
是可逆的,在通常条件下有70%~90%向正反应方向转化。
(1)若溴苯中混有杂质苯甲醛,欲将此杂质全部除去,可采用的试剂是__________________,其分离方法为__________________。
(2)若在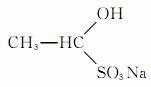 水溶液中加入足量盐酸,有机物转化为________,将该转化产物分离出来的常用方法是________。
水溶液中加入足量盐酸,有机物转化为________,将该转化产物分离出来的常用方法是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是( )
A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO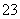 和OH-
和OH-
B.NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)
C.10 mL 0.10 mol·L-1 CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学实验的描述正确的是
A.用红色石蕊试纸检验NH3、用pH试纸测溶液的pH,必须先用蒸馏水润湿试纸
B.分液漏斗、容量瓶在使用前必须检查是否漏水
C.过滤、蒸发、配制0.1mol/LNaCl溶液,都必须使用烧杯和玻璃棒
D.实验室用自来水制蒸馏水、石油分馏、制乙烯,都必须使用温度计
查看答案和解析>>
科目:高中化学 来源: 题型:
I.二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”。
(1)工业上采用氯酸钠制备ClO2:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是 (填字母序号)。
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
②当生成0.4molClO2时,转移电子 mol。
③若采用双氧水还原氯酸钠制备ClO2,更适合用于饮用水的消毒,其主要原因是 。
(2)ClO2在杀菌消毒的同时,可将剧毒氰化物氧化成无毒气体而除去,写出用ClO2
氧化除去CN-的离子方程式 。
II.下图甲是用H2还原 CO2制备甲醇的原电池工作原理示意图;图乙是用图甲作电源实现CO2制备碳氢化物的工作原理示意图(用KHSO4溶液作电解液)。
(1)图甲中A的电极名称是 。
(2)若乙中碳氢化物为C2H4, 则铜电极的电极反应为 。
(3)若通入的CO2全部参加反应,甲乙中共消耗0.6molCO2 时,图甲中通过质子交换膜的H+ 的物质的量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
氨是合成硝酸、铵和氮肥的基本原料,回答下列问题:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的PH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
 (2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
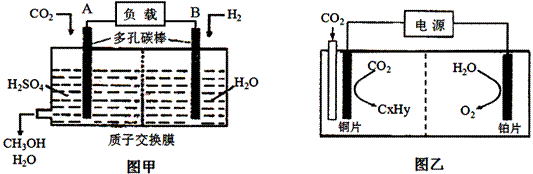
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1molN2, 其△H= kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
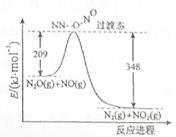
.如图中A、B、H都属于盐类,A和B的水溶液都能使酚酞变红,H是人们日常生活中最常用的食品添加剂之一,E是淡黄色固体
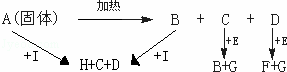
(1)写出下列物质的化学式FNaOH,IHCl
(2)写出下列反应的化学方程式:A→B+C+D
;C+E→B+G2;D+E→F+G
(3)写出下列反应的离子方程式:A+I→H+C+D;B+I→H+C+D.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com