
X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示,已知Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )

A.只由这四种元素不能组成有机化合物
B.最高价氧化物对应水化物的酸性:W<Z
C.Z的单质与氢气反应的气体产物无色无味
D.X、Y形成的化合物都易溶于水
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是( )
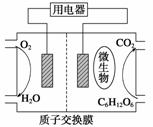
A.该电池能够在高温下工作
B.电池的负极反应式为C6H12O6+6H2O—→6CO2↑+24H++24e-
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体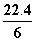 L
L
查看答案和解析>>
科目:高中化学 来源: 题型:
偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2(l)+2N2O4(l)====2CO2(g)+3N2(g)+4H2O(g) (Ⅰ)
(1)反应(Ⅰ)中氧化剂是_________。
(2)火箭残骸中常出现红棕色气体,是因为:N2O4(g)  2NO2(g) (Ⅱ)
2NO2(g) (Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为____________(填“吸热”或“放热”)反应。
(3)一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4充入一恒压密闭容器中,下 列示意图正确且能说明反应达到平衡状态的是__________。
列示意图正确且能说明反应达到平衡状态的是__________。
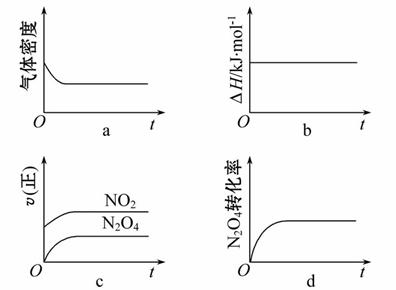
若在相同温度下,上述反应改在体积为1 L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应3 s后NO2的物质的量为0.6 mol,则0~3 s内的平均反应速率v(N2O4)= ______mol·L-1·s-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
夏天,鸡没有汗腺只能依赖“喘息”调节体温。鸡过度地呼出CO2,使下列平衡向左移动导致蛋壳变薄,使农场主和超市经营者蒙受经济损失。
CO2(g) CO2(aq),
CO2(aq),
CO2(aq)+H2O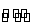 H2CO3(aq)
H2CO3(aq)
H2CO3(aq)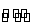 H+(aq)+HCO3- (aq),
H+(aq)+HCO3- (aq),
HCO3- (aq)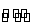 H+(aq)+CO32- (aq)
H+(aq)+CO32- (aq)
Ca2+(aq)+CO32- (aq)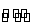 CaCO3(s)(蛋壳)
CaCO3(s)(蛋壳)
澳大利亚学者研究发现,夏季给鸡喂食下列某种饮料会使蛋壳变厚,这种饮料是( )
A.淡盐水 B.碳酸水
C.蔗糖 D.澄清石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室常用邻苯二甲酸氢钾(KHC8H4O4)来测定氢氧化钠溶液的浓度,反应如下:KHC8H4O4+NaOH====KNaC8H4O4+H2O。邻苯二甲酸氢钾溶液呈酸性,滴定到达终点时,溶液的pH约为9.1。
(1)为测定N aOH溶液的浓度,准确称取一定质量的邻苯二甲酸氢钾(KHC8H4O4)加入到250 mL锥形瓶中,加入适量蒸馏水溶解,应选用__________作指示剂,到达终点时溶液由__________色变为__________色,且半分钟不褪色。(提示:指示剂变色范围与滴定终点pH越接近误差越小)
aOH溶液的浓度,准确称取一定质量的邻苯二甲酸氢钾(KHC8H4O4)加入到250 mL锥形瓶中,加入适量蒸馏水溶解,应选用__________作指示剂,到达终点时溶液由__________色变为__________色,且半分钟不褪色。(提示:指示剂变色范围与滴定终点pH越接近误差越小)
(2)在测定NaOH溶液浓度时,有下列操作:①向溶液中加入1滴~2滴指示剂; ②向锥形瓶中加20 mL~30 mL蒸馏水溶解; ③用NaOH溶液滴定到终点,半分钟不褪色;④重复以上操作; ⑤准确称量0.400 0 g~0.600 0 g邻苯二甲酸氢钾加入到250 mL锥形瓶中;⑥根据两次实验数据计算NaOH的物质的量浓度。
以上各步操作中,正确的操作顺序是__________。
(3)上述操作中,将邻苯二甲酸氢钾直接放在锥形瓶中溶解,对实验是否有影响?________________________________________。(填“有影响”或“无影响”)
(4)滴定前,用蒸馏水洗净碱式滴定管,然后加待测定的NaOH溶液滴定,此操作使实验结果__________。(填“偏大”“偏小”或“无影响”)
(5)现准确称取KHC8H4O4(相对分子质量为204.2)晶体两份质量均为0.510 5 g,分别溶于水后加入指示剂,用NaOH溶液滴定至终点,消耗NaOH溶液体积平均为20.00 mL,则NaOH溶液的物质的量浓度是多少?(结果保留四位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是元素周期表的一部分,已知A、B、C、D、E均为短周期元素,D元素最外层电子数为最内层电子数的3倍,下列说法中正确的是( )
| A | B | C |
| D | E |
A.元素A位于第二周期ⅣA族
B.原子半径:B>C
C.最高价氧化物对应水化物的酸性:C>E
D.气态氢化物的稳定性:D>B
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列热化学方程式:①Zn(s)+1/2O2(g)===ZnO(s) ΔH1;②Hg(l)+1/2O2(g)===HgO(s) ΔH2。则反应Zn(s)+HgO(s)===Hg(l)+ZnO(s)的ΔH为( )
A.ΔH1-ΔH2 B.ΔH2-ΔH1
C.ΔH1+ΔH2 D.-(ΔH1+ΔH2)
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积恒定的密闭容器中,一定量的SO2与1.1 mol O2发生反应:2SO2(g)+O2(g)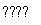 2SO3(g) ΔH<0。当气体的物质的量减少0.315 mol时,反应达到平衡,SO2的平衡转化率是90%。下列说法正确的是(双选)( )
2SO3(g) ΔH<0。当气体的物质的量减少0.315 mol时,反应达到平衡,SO2的平衡转化率是90%。下列说法正确的是(双选)( )
A.相同条件下,平衡时若充入稀有气体,SO2的转化率增大
B.反应开始时,向容器中通入的SO2的物质的量是0.7 mol
C.保持其他条件不变,仅降低温度,正反应速率减小程度比逆反应速率减小程度大
D.保持其他条件不变,仅缩小容器体积,反应达到平衡时容器中气体的物质的量小于1.485 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
鉴别少量乙烯与乙炔气体的实验方法是( )
|
| A. | 通入溴水中,观察溴水的消耗量 |
|
| B. | 通入酸性KMnO4溶液中,观察溶液是否褪色 |
|
| C. | 点燃后观察燃烧现象 |
|
| D. | 闻气味 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com